キーワード:示差走査熱量測定、ハイスループット熱安定スクリーニング、短期熱安定性
MC177-JA
要約
バイオ医薬品の熱安定性試験は、製品の品質を保証し、バイオ医薬品の規制承認をサポートする上で重要です。TA Instruments™ RS-DSC (迅速スクリーニング – 示差走査熱量計)は、最大 24 件のサンプルを同時に分析できるプラットフォームを提供します。さらに、低容量の使い捨て式マイクロ流体チップを使用し、高濃度のタンパク質医薬品候補を評価することができます。このアプリケーションノートでは、検出限界を評価し、示差走査熱量測定(DSC)分析に適した濃度範囲を示すことにより、TA Instruments RS-DSC の有用性を明かにするデータを提供します。
はじめに
短期熱安定性試験は、保存可能期間を予測し、有効性を維持する鍵となる、熱応力に対する化合物の耐性を評価する上で重要です。示差走査熱量測定(DSC)は、抗体構造を把握するために使用される技術ですが、従来の装置では製剤濃度サンプルの特性評価を行うことは困難でした。これらの問題は、使用するサンプルセルの取替えができないため、クリーニングに長い時間がかかってスキャン間のサンプルのキャリーオーバーができないことが原因となっています。また、高濃度のタンパク質は加熱によりセルを詰まらせやすくするため、固定されたサンプルセルには濃度範囲に上限があります。理想的な状態であったとしても、詰まったセルを再生するためには大がかりな洗浄が必要です。最悪の場合、セルが不可逆的に汚染される可能性があります。そのため、サンプルを製剤濃度から希釈する必要があります。濃度はタンパク質の熱安定性に影響するため、貯蔵条件下で薬剤のタンパク質安定性を正確に把握するためには、製剤強度のサンプルを使って試験を行う必要があります。
TA Instruments RS-DSC は、示差走査熱量測定技術の革新的な進歩です。他の DSC とは異なり、TA Instruments RS-DSCは、使い捨て可能なマイクロ流体チップを使って少量の高濃度バイオ医薬品を処理するユニークな設計なので、サンプルを希釈する必要はありません。この技術統合により、計測の合間に装置の測定セルを繰り返し洗浄する必要がなくなり、時間を節約し、汚染リスクを低減し、より信頼性の高い測定ができるようになります。サンプルの調製から、密封、分析の準備までを1分以内に行うことができ、最小限の容量で正確な評価を行うことができます。TA Instruments RS-DSCは、同時に 24 件のサンプルを分析することで、熱安定性試験環境に新たな定義をもたらす、バイオ医薬品業界に向けたハイスループット熱安定性試験の新しいプラットフォームです。熱分析を通じて包括的な物理化学的知見を明らかにすることで、医薬品の開発を促進し、効率的な市場投入を可能にします。

実験と方法
ハーセプチン™ /トラスツズマブは、パッケージの指示に従い、ヒスチジン製剤緩衝液(トレハロース二水和物 18.4 mg/mL 、ポリソルベート 20 0.08 mg/mL、ヒスチジン塩酸塩 0.49 mg/mL、ヒスチジン 0.32 mg/mL、pH 6.0)を 21 mL で調製し、使用する直前まで 4 °C で保存しました。リン酸緩衝生理食塩水(PBS)を使った分析では、抗体は Amicon™Ultra 10kDa 分子量カットオフ遠心スピンフィルターを使って、Gibco™ DPBS、EDTA 1 mM 、pH 7.4 で構成された PBS にバッファー交換され、目的の濃度に調整し、3回試験を行いました。
高濃度タンパク質溶液の評価に使用した鶏卵白由来のリゾチームは、Sigma Aldrich(L6876)から入手し、グリシン緩衝液(0.1Mグリシン、pH2.5)で調製しました。タンパク質サンプルは、Amicon Ultra 3kDa 分子量カットオフ遠心スピンフィルターを使用して、330 mg/mL に濃縮しました。希釈液は、この濃縮液を希釈して作成しました。タンパク質濃度を調製した直後に TA Instruments RS-DSC を使って3回試験を行いました。
タンパク質サンプルは、11 μ L の液体サンプル用に設計されたチャネルを備えた使い捨て式のガラスマイクロ流体チップ(MFC)にピペットで直接注入しました。タンパク質溶液を加えた後、MFC を粘着性のあるガラス製カバースリップで密封し、100 ° C まで加熱し、TA Instruments RS-DSC に挿入しました(図1)。MFC を組み立てた後、ツインカロリメーターのサンプル側に配置しました。再利用可能なポリエーテルエーテルケトン(PEEK)チップはリファレンス側に配置しました。最大温度範囲 20~100 °C、および事前設定スキャン速度 1° C/分または 2 ° C/分で、最大 24 件のサンプルを同時に実行できます。次のスキャンを行う前にクリーニングする必要がなくなるため、1日の通常の労働時間で最大 96 件のサンプルを実行することができます。
TA Instruments RS-DSCは、RS-DSCRun ソフトウェアで動作し、各スキャン開始前の 1800 秒間に初期温度で平衡するよう設定しました。各サンプルにつき試験を3回ずつ実行し、全温度範囲(20~100 ° C)で1または2 ° C/分でスキャンを実行しました。
24 件のすべての熱量計の精度を確保するため、装置はまずジパルミトイルホスファチジルコリン (DPPC)で校正および検証され、各熱量計の許容 Tmaxの予想文献値からの推移は 0.2 ° C未満としました[1]。
データは、NanoAnalyze™ ソフトウェア (v4.0.0)を使って処理されました。ソフトウェアの新機能により、熱変性中点(Tmax)の自動検出と、最大 96 件のサーモグラムの比較が可能になります。NanoAnalyze Software v4.0.0 には、新しいソフトウェアアルゴリズム RapidDSC が搭載されています。これは、指定されたデータ範囲のピークを検索することにより、DSC サーモグラムの Tmax を自動的に検出します。自動的に検出された基準値がピーク全体に適用され、Tmax 温度をさらに調整して精度を向上するために使用されます。自動ピーク検出機能が、対象となる温度範囲の最大3つのピークを表示します。自動機能は、「Baseline and Tmax Editor」(ベースラインと Tmax エディター)ポップアウトウィンドウで簡単に編集でき、検出ウィンドウを絞り込んだり、ピークを識別するために特定の範囲を選択したり、自動検出されたベースラインと Tmax を調整することができます。自動検出された Tmaxは、容易に比較できるよう表形式データとしてエクスポートしたり、RapidDSC内の Tmax「視覚化」タブおよび「オーバーレイ」タブで表示することもできます。
結果と考察
TA Instruments RS-DSC 検出限界
少量のサンプル量では、データの感度と精度に必要な濃度限界を理解することが重要です。高速スキャンによりシグナル強度が強くなり、検出限界または限界付近でタンパク質濃度を分析しやすくなります。多段階の構造変化を重ねるタンパク質に必要な濃度を理解するため、抗体ハーセプチン/トラスツズマブを PBS 中で様々な濃度に調整し、スキャン速度 2℃/分で3回評価しました(図2および表1)。
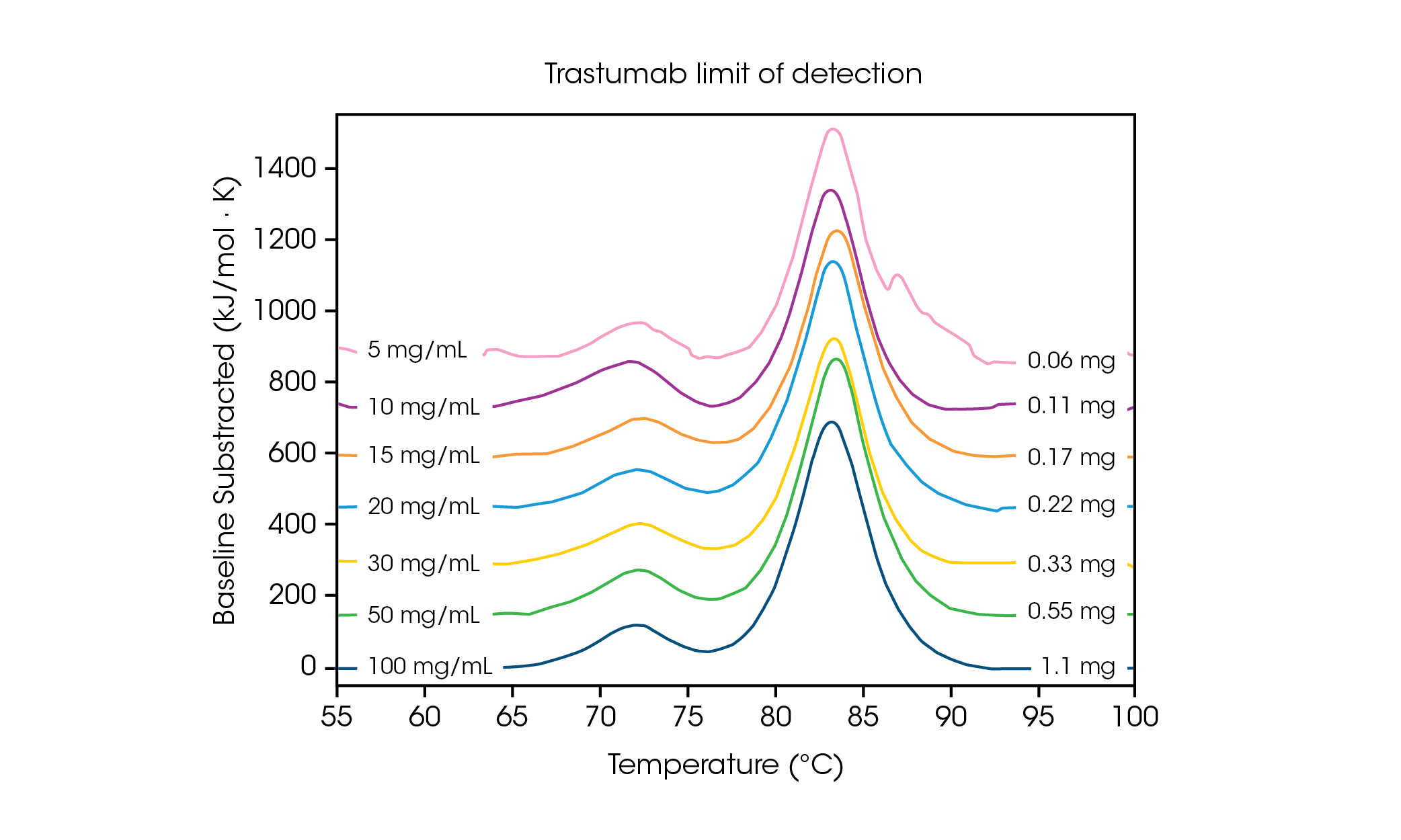
表1. 検出限界スクリーニングにおける転移温度と再現性。Mean ± SD, n = 3.
| Conc. | Tmax、1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 5 mg/mL | 72.57 ± 0.52 | 83.06 ± 0.09 |
| 10 mg/mL | 71.83 ± 0.29 | 82.98 ± 0.05 |
| 15 mg/mL | 72.13 ± 0.23 | 83.17 ± 0.11 |
| 20 mg/mL | 71.88 ± 0.01 | 82.99 ± 0.08 |
| 30 mg/mL | 71.91 ± 0.12 | 83.10 ± 0.03 |
| 50 mg/mL | 71.93 ± 0.08 | 83.20 ± 0.02 |
| 100 mg/mL | 71.85 ± 0.01 | 83.01 ± 0.01 |
濃度 100mg/mL では、平均 Tmax,1 が 71.85℃ の CH2 ドメインのアンフォールディングと、平均 Tmax,2 が 83.01℃ の Fa bドメインと CH3 ドメインの組み合わせに対応する2つの転移が明確に見られました。 [2]タンパク質濃度が低下しても安定性に有意な変化は見られず、熱量計間での優れた再現性が観察されました。20mg/mL のハーセプチン/トラスツズマブでは、CH2 アンフォールディング転移の規模は著しく低下しましたが、3回のサンプル測定では優れた再現性を実現しました(図3)。20mg/mL 以下のサンプルでは、より小さい CH2アンフォールディングドメインの分析が困難になり、検出された Tmax,1のばらつきが大きくなりました。Fab と CH3 ドメインの複合体(Tmax,2)などの、より大きなアンフォールディング事象は、5mg/mL などの低濃度でも容易に検出されました。他のすべての DSC 装置と同様、より鋭く幅の狭いピークにより最高の再現性が得られます。検出限界はサンプルに依存し、タンパク質の複雑性や溶液環境によって変化します。
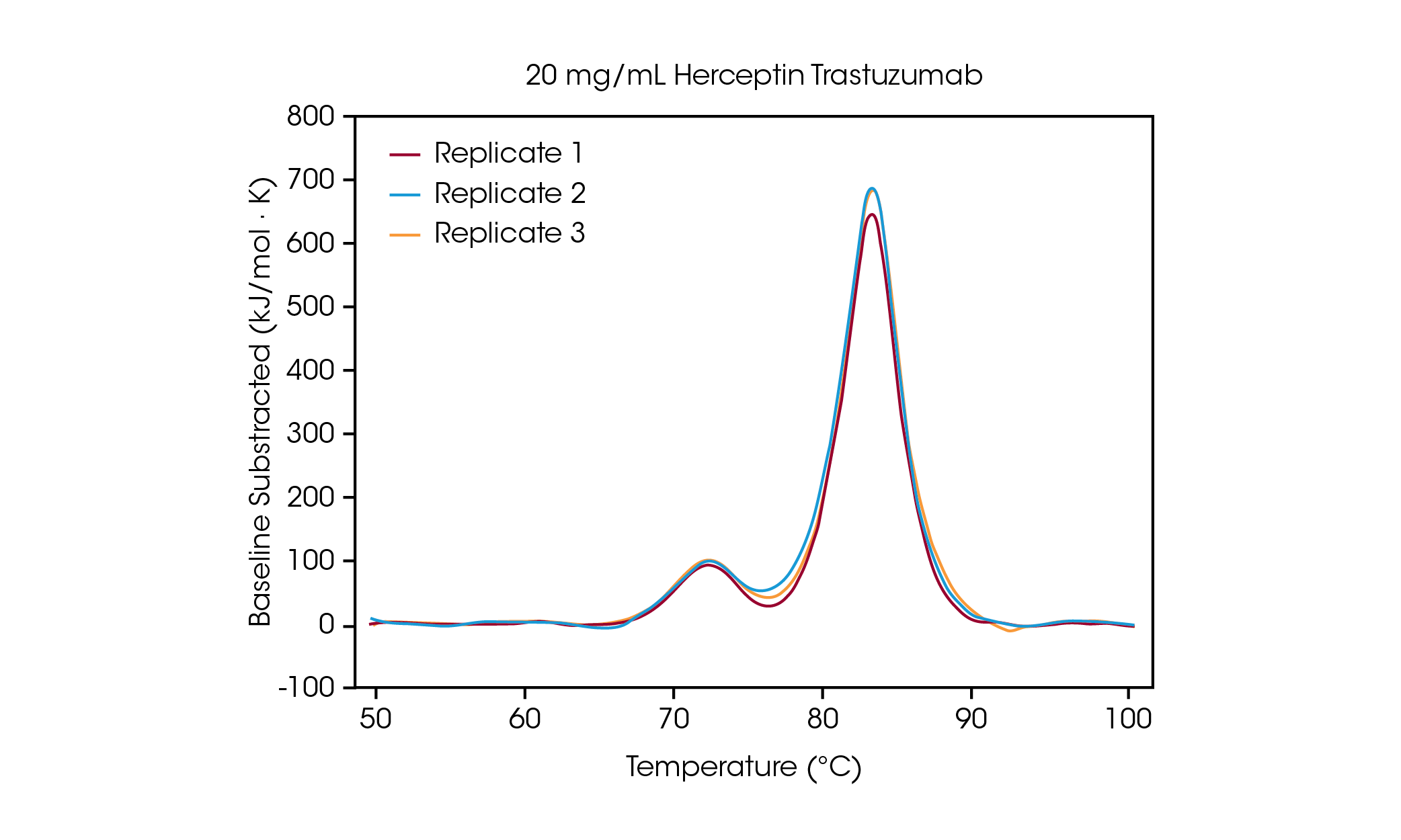
熱安定性に対する濃度依存性の検討
TA Instruments RS-DSCは、抗体医薬品および抗体医薬品複合体に特化した高濃度のバイオ医薬品サンプルを処理するために独自に設計されています。抗体治療薬がますます成功を収めるようになる中で、製薬業界では皮下および眼への薬物投与を可能にする高濃度剤形への関心が高まっています。そのため、50~150 mg/mL の抗体濃度が一般化しており、中には 200 mg/mL 以上に達するものもあります。[3]。高濃度でタンパク質を配合すると、物理的に不安定化しやすくなることがあります[4, 5]。反対に、濃度を高くすると熱安定性が向上するという研究結果もみられます [6]。したがって、対象となる製剤濃度における熱変性と溶液環境への反応を理解することは、医薬品の製造物責任を軽減する上で重要な基準となります。
TA Instruments RS-DSCは、使い捨て式マイクロ流体チップにタンパク質サンプルを封入する設計になっています。従来のマイクロカロリメーターは固定されたサンプルセルを使っており、実験のたびに洗浄する必要がありました。アンフォールディングの過程で沈殿やゲル化が生じやすい高濃度サンプルは洗浄が難しく、最悪の場合はセルを損傷する可能性があります。TA Instruments RS-DSC で使用される使い捨て式マイクロ流体チップは、使いやすく、時間を要する洗浄プロトコルが不要なだけでなく、高濃度タンパク質サンプルをリスクなく試験することを可能にします。
高濃度のタンパク質サンプルを試験する能力を例示し、目的の配合濃度で試験することの重要性を説明するために、グリシン緩衝液中の 30 ~ 330 mg/mL の鶏卵白リゾチームを評価しました(図4および表2)。リゾチームは、低濃度 (約 1 mg/mL) で簡素な単一転移サーモグラムが得られるので、DSC の参照試験サンプルとして一般的に使用されます。それより最大 100 倍高いタンパク質濃度を評価して、リゾチームの安定性に濃度依存性があることを観察しました。
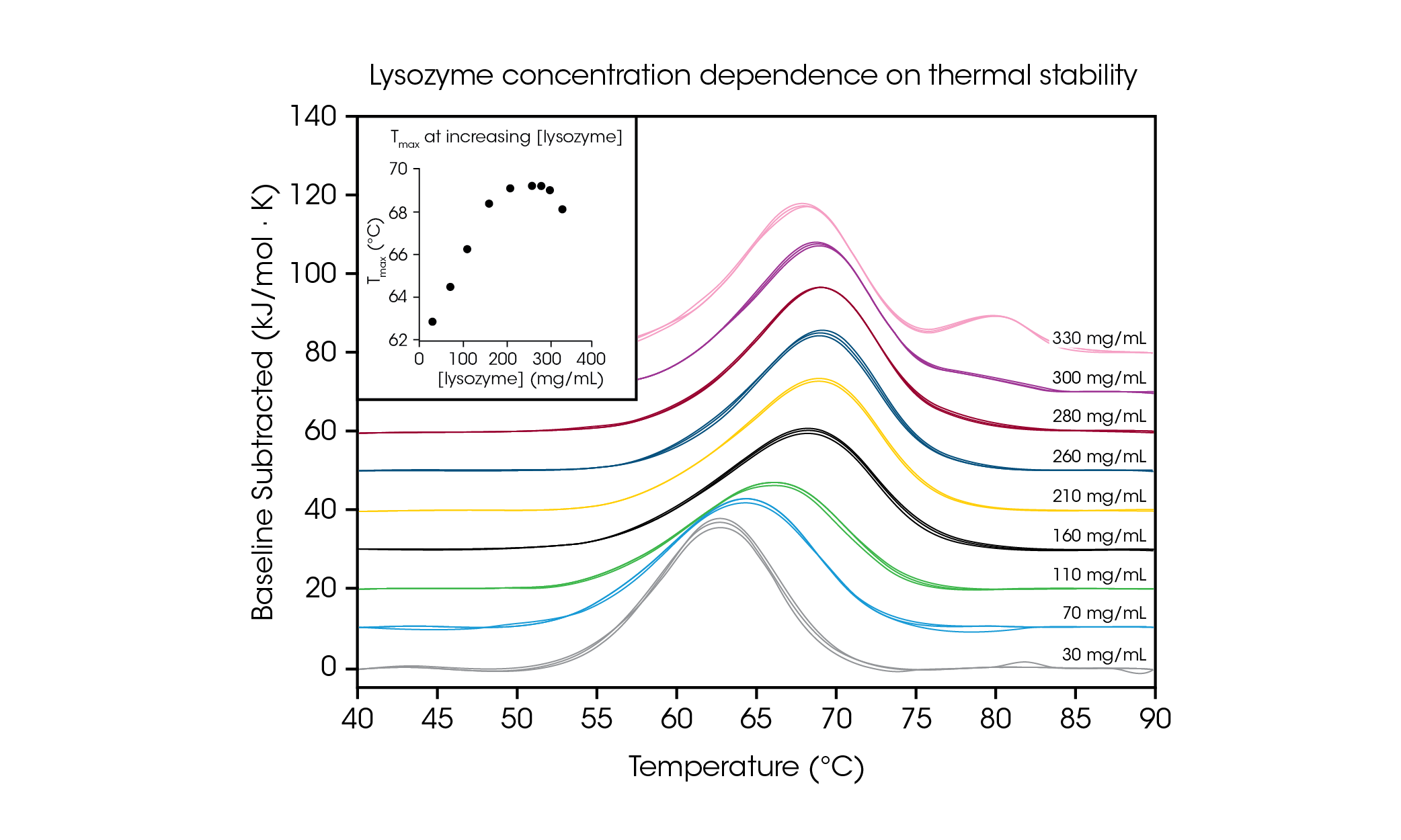
表2. 転移温度とリゾチーム濃度依存性スクリーニング全体の再現性。Mean ± SD, n = 3.
| Conc. | Tmax (°C) |
|---|---|
| 330 mg/mL | 68.14 ± 0.05 |
| 300 mg/mL | 69.00 ± 0.04 |
| 280 mg/mL | 69.22 ± 0.04 |
| 260 mg/mL | 69.19 ± 0.09 |
| 210 mg/mL | 69.08 ± 0.06 |
| 160 mg/mL | 68.39 ± 0.04 |
| 110 mg/mL | 66.27 ± 0.09 |
| 70 mg/mL | 64.68 ± 0.05 |
| 30 mg/mL | 62.81 ± 0.06 |
本試験で使用した最低濃度である 30mg/mL でのリゾチームの Tmaxは 62.81℃ でした。濃度を 160 mg/mL まで増加させると、安定性は直線的に増加し(図4の挿入図を参照)、Tmaxは 68.39 °C に達しました。210~280mg/mL では、熱安定性は Tmax 約 69.2℃ に達した後、横ばいに推移しました。興味深いことに、濃度 300 mg/mL では、主要な転移のテール部にショルダーピークが 80℃ 付近で現れ始め、主要な転移の全体的な安定性は Tmax 69.00℃ とわずかに低下しました。最高濃度の 330 mg/mL では、主要な転移の熱安定性 Tmax,1 は 68.14 °C まで低下し、Tmax,2 80.28±0.04 °C でもう1つのピークが観察されました。高濃度試験が可能な TA Instruments RS-DSC は、リゾチーム濃度約 300mg/mL 以上で、高次構造の形成を観察することができました。この研究では、高タンパク質濃度で高品質のデータを取得する能力が実証されたこと加え、希釈によってタンパク質の安定性が変化する可能性があるため、目的の濃度でバイオ医薬品を試験することの重要性も明らかになりました。
結論
従来の単一サンプル DSC 技術は高い精度が得られますが、大量のサンプルを必要とし、医薬品開発プロセスにおいて時間のかかる技法とされてきました。TA Instruments RS-DSC は、最大 24 件のサンプルを同時に分析することにより、高スループットの熱安定性試験が可能になります。シンプルなワークフロー、並列試験によるデータ取得速度の向上、自動ピーク検出アルゴリズムによる解析の高速化により、結果を得るまでの時間が大幅に改善されました。ここでは、20 mg/mL までの複雑な多段階の構造変化を重ねる抗体サンプルの分析が、正確で再現可能であることを実証しました。2℃/分とより高速なスキャン速度により、より振幅の大きいシグナルが得られ、検出限界付近でのサンプルの分析を行うことができるようになります。最高で 330mg/mL までの高濃度リゾチーム溶液の研究から、熱安定性に想定外の濃度依存性があることが明らかになり、目的の薬物生成物濃度を評価することの重要性が浮き彫りになりました。これらを総合すると、TA Instruments RS-DSC は、熱応力に対する耐性や製品の品質を理解し、規制当局の承認をサポートするために重要な、バイオ医薬品の安定性を評価するための新しいプラットフォームを提供すると言えるでしょう。
参考文献
- “Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters,” ASTM E2603-15, 2023.
- K.J. Arlotta, A. V. Gandhi, H.-N.Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, “In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution,” Antibodies, vol. 7, p. 6, 2018.
- R.G. Strickley and W. J. Lambert, “A review of formulations of commercially available antibodies,” Journal of Pharmaceutical Sciences, vol. 110, pp. 2590-2608, 2021.
- J.Zarzar, T. Khan, M. Bhagawati, B. Weiche, J. Syndow-Andersen and S. Alavattam, “High concentration formulation developability approaches and considerations,” MAbs, vol. 15, pp. 1-13, 2023.
- S.J. Shire, Z. Shahrokh and J. Liu, “Challenges in the development of high protein concentration formulations,” Journal of Pharmaceutical Sciences, vol. 93, pp. 1390-1402, 2004.
- C.Zhang, J. W. Bye, L. H. Lui, H. Zhang, J. Hales, S. Brocchini, R. A. Curtis and P. A. Dalby, “Enhanced Thermal Stability and Reduced Aggregation in an Antibody Fab Fragment at Elevated Concentrations,” Molecular Pharmaceutics, vol. 20, pp. 2650-2661, 2023.
このアプリケーションノートの印刷用バージョンをダウンロードするにはこちらをクリックしてください。

