キーワード:示差走査熱量測定、モノクローナル抗体(mAb)、抗体医薬品、短期的熱安定性、ハイスループット、医薬品開発
MC178-JA
要約
短期的な熱安定性試験は、製品の品質を保証し、抗体医薬品の規制承認をサポートする上で重要です。TA Instruments™ RS-DSC (迅速スクリーニング-示差走査熱量計)は、緩衝液の調製およびタンパク質配列修飾の熱安定性スクリーニングに使用されるものです。この装置は、製剤強度をもたらす濃度で最大 24 件のサンプルを同時に分析するプラットフォームを提供します。このアプリケーションノートでは、緩衝液の短期的な熱安定性スクリーニングおよび抗体医薬品の開発におけるタンパク質修飾分析における TA Instruments RS-DSC の有用性を表すデータについて説明します。
はじめに
抗体の構造と機能の関係を把握することは、溶液条件の変化や配列の変更などによって機能的な変動が生じる仕組みを理解する上で不可欠です。抗体構造の特性評価は、これらの違いを明確にする重要なステップです。また、様々な熱条件下で生体分子の安定性を評価することは、これらの医薬品の品質と規制承認を確保する上で重要です。
示差走査熱量測定(DSC)は、抗体の構造を理解し、化合物の熱応力に対する耐性を評価するために使用される熱分析技術です。短期熱安定性は、抗体医薬品の評価に重要な品質特性です。これは候補の選択と予備製剤に使用される重要な指標であり、臨床製剤の開発において、賦形剤、緩衝塩、界面活性剤、pH などの緩衝液組成を選択する上で重要なパラメータとなります。スクリーニングの性質上、通常は数十から数百のサンプルが実行され、分析されます。従来の DSC 研究は長い時間を要し、1回に1つのサンプルしか検査できず、最良の結果を得るためにはサンプル間で細心の注意を払って洗浄する必要があります。TA Instruments RS-DSC は、ハイスループット熱安定性試験の新しいプラットフォームで、24 件のサンプルを同時に分析することにより、熱安定性試験環境に新たな定義をもたらします。熱分析を通じて迅速かつ総合的な物理化学上の知見を提供することで、新薬を市場に投入するコストと時間が削減できます。
抗体の DSC サーモグラム(自記温度記録図)は非常に多様です。抗体によっては単一のピークを示すものもあれば、複数の明確なピークを示すものや、より大きなアンフォールディングのショルダーピークとして現れるオーバーラップしたピークを示すものもあります。こうしたサーモグラムの多様性は、ヒンジ領域の柔軟性と相関することが示唆されてきました[1]。マルチドメイン・タンパク質に関する研究は、これらの複雑でオーバーラップしたピークポイントがドメイン間の相互作用によってもたらされる可能性を示唆しています[2]。先進的な DSC 研究では、抗体の重鎖部分の個々のドメインを変性させる温度をさらに正確に特定することに成功しています[3]。バイオ医薬品に一般的にみられる問題として、熱安定性は溶解性に大きく影響するため、これらの研究の最終的な目標は熱安定性を確認することです。

実験と方法
ハーセプチン™ /トラスツズマブをパッケージの指示に従い、ヒスチジン製剤緩衝液(トレハロース二水和物 18.4 mg/mL 、ポリソルベート 20 0.08 mg/mL、ヒスチジン塩酸塩 0.49 mg/mL、ヒスチジン 0.32 mg/mL、pH 6.0)を 21 mL で調製し、使用する直前まで4 °Cで保存しました。異なるバッファで分析するため、Amicon™ Ultra 10kDa 分子量カットオフ遠心式スピンフィルターを使って抗体をバッファ交換しました。
ほう酸塩緩衝液は、ほう酸 50 mM、塩化ナトリウム 50 mM 、EDTA 2 mM、pH 8.0 で調製しました。一般的な作業緩衝液である PBS は、Gibco™ DPBS と 1 mM の EDTAで pH 7.4 で調整しました。トラスツズマブ抗体の構造分子の上に構築された抗体薬物複合体である KADCYLA™ に使用されるコハク酸製剤緩衝液は、10 mM のコハク酸ナトリウム、6% w/v スクロース、pH 5.0 で調製しました。
変異スクリーニング用の抗体サンプルは、Cell Signaling Technology 社によって設計・供給され、分析用に PBS(pH 7.4)、20 mg/mL で調製しました。
タンパク質サンプルは、11 μ L の液体サンプル用に設計されたチャネルを備えた使い捨て式のガラスマイクロ流体チップ(MFC)にピペットで直接注入しました。タンパク質溶液を加えた後、マイクロ流体チップは粘着性のあるガラス製カバースリップで密封され、サンプルを100 °Cで加熱しました。MFC を組み立てた後、TA Instruments RS-DSC のツインカロリメーターの各サンプル側に配置しました(図1)。再利用可能なポリエーテルエーテルケトン(PEEK)チップはリファレンス側に配置しました。温度範囲 20~100 °C、および事前設定スキャン速度 1 または 2 ° C/分で、最大 24 件のサンプルを同時に実行できます。次のスキャンを行う前にクリーニングする必要がなくなるため、1日の通常の労働時間で最大 96 件のサンプルを実行することができます。
TA Instruments RS-DSCは RS-DSCRun ソフトウェアで動作し、各スキャン開始前の 1800 秒間に初期温度で平衡するよう設定しました。各サンプルにつき試験を3回ずつ実行し、全温度範囲(20~100 ° C)で 1 または 2 ° C/分でスキャンを実行しました。
24 件のすべての熱量計の精度を確保するため、装置はまずジパルミトイルホスファチジルコリン (DPPC)で校正および検証され、許容 Tmax の予想文献値からの推移は 0.2 ° C 未満としました[4]。
データは、NanoAnalyze™ ソフトウェア (v4.0.0)を使って処理されました。NanoAnalyze ソフトウェアの新機能により、熱変性中点(Tmax)の自動検出と、最大 96 件のサーモグラムの比較が可能になります。NanoAnalyze Software v4.0.0 には、新しいソフトウェアアルゴリズム RapidDSC が搭載されています。これは、指定されたデータ範囲のピークを検索することにより、DSC サーモグラムの Tmaxを自動的に検出します。自動的に検出された基準値がピーク全体に適用され、Tmax 温度をさらに調整して精度を向上するために使用されます。自動ピーク検出機能が、対象となる温度範囲の最大3つのピークを表示します。自動機能は、「Baseline and Tmax Editor」(ベースラインと Tmaxエディター)ポップアウトウィンドウで簡単に編集でき、検出ウィンドウを絞り込んだり、ピークを識別するために特定の範囲を選択したり、自動検出されたベースラインと Tmaxを調整することができます。自動検出された Tmaxは、容易に比較できるよう表形式データとしてエクスポートしたり、RapidDSC 内の Tmax「視覚化」タブおよび「オーバーレイ」タブで表示することもできます。
NanoAnalyze ソフトウェアによる手動分析を、RapidDSC を使って自動検出された Tmax と比較しました。自動ピーク検出機能と手動分析を比較できるよう、各スキャンを活性セル容積中のタンパク質のモル数でモル熱容量に正規化しました。4次または5次多項式を、正規化されたデータのベースラインとして適用しました。Tmaxを目視して予想し、各転移で自動検出された Tmaxと比較しました。より詳細なサーモグラムの分析は、「NanoDSC:What to Consider when Choosing a Baseline and Model」[5]に説明されるモデルを当てはめて完了できます。抗体の安定性の分析には、Voigt モデルを使用することが推奨されます。
結果と考察
製剤バッファーのスクリーニング
熱安定性はバイオ医薬品の重要な品質特性です。DSC は、タンパク質の安定性に対する溶液環境の影響を評価するために採用される主要なツールです。タンパク質の安定性は、pH、緩衝液のタイプ、イオン強度、賦形剤、界面活性剤など、溶液環境の様々な変数の影響を受けます。これらの効果が Tmax にもたらす影響は、わずかな変動から最高数十度にわたる大きな変動として現れることがあります[6]。バイオ医薬品業界のニーズを考慮して設計された TA Instruments の RS-DSC の平行スループットは、生物学的タンパク質製剤の溶液条件のスクリーニングを容易にし、
従来のマイクロ熱量測定法よりも迅速な意思決定を可能にします。
製剤スクリーニングで得られたデータがバッファ成分の選択にどのように役立つかを実証するために、抗体医薬品であるハーセプチン/トラスツズマブを4つの一般的なバッファ条件で評価しました(図2および表1)。この研究では、様々な配合成分のバッファー中の抗体を約20 mg/mL でスクリーニングしました。TA Instruments RS-DSC は、最大 330 mg/mL を超える製剤強度のタンパク質濃度を処理できるユニークな設計を備えているため、医薬品を希釈することなく熱安定性試験を行うことができます。詳細は、TA Instruments のアプリケーションノート、「Rapid Thermal Stability Screening of High Concentration Biologic Drugs」をご覧ください[7]。
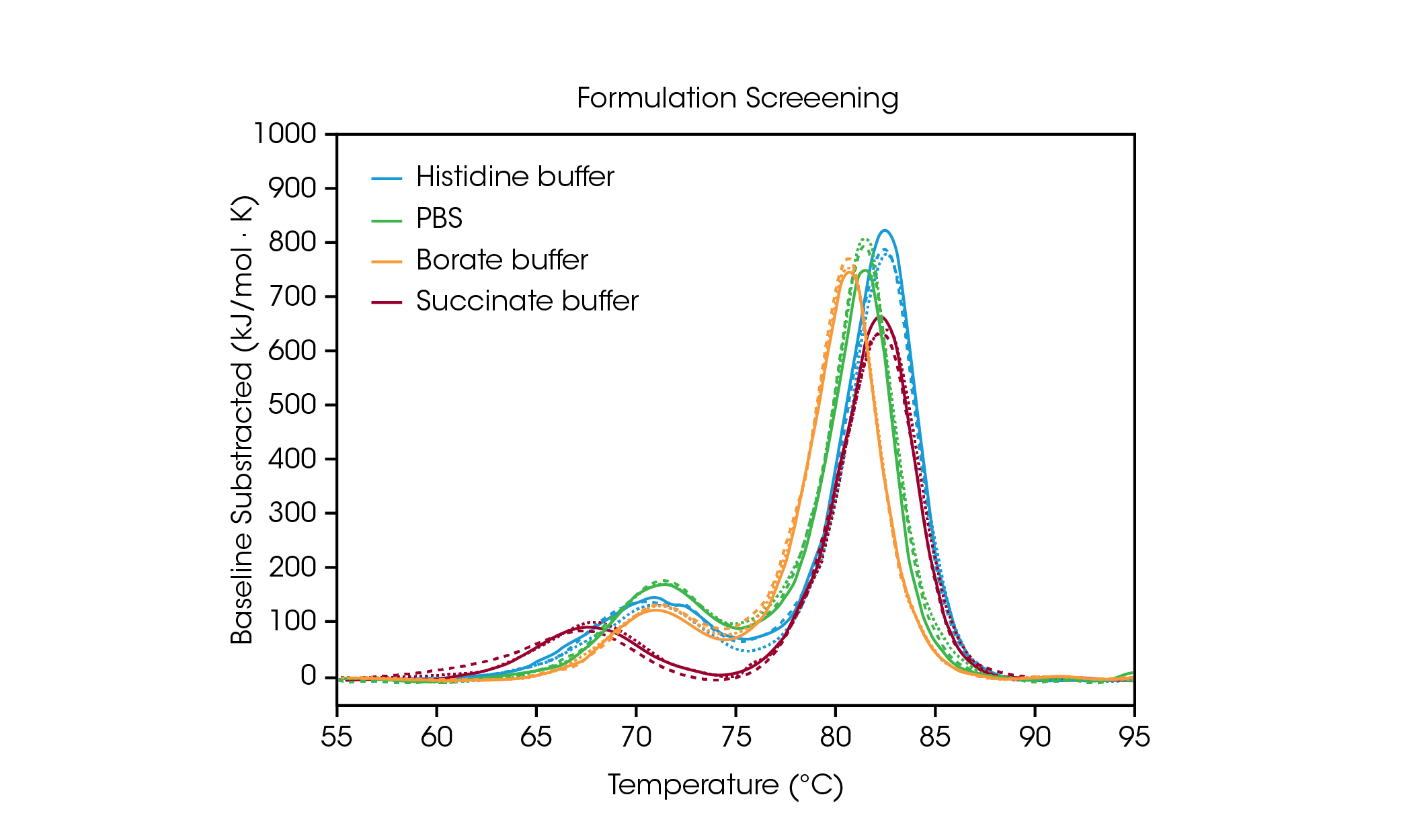
表1. 製薬スクリーニングにおける転移温度。平均 ± SD, n = 3.
| バッファ | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| ヒスチジン | 70.76 ± 0.38 | 82.66 ± 0.09 |
| ほう酸塩 | 70.84 ± 0.08 | 80.69 ± 0.02 |
| PBS | 71.12 ± 0.06 | 81.48 ± 0.02 |
| コハク酸 | 67.71 ± 0.22 | 82.66 ± 0.08 |
第一のアンフォールディング事象は、CH2 ドメインの変性に相当し、ヒスチジン、ホウ酸塩、または PBS の緩衝[8]液による影響はあまり受けません。その反面、コハク酸緩衝液は、CH2 ドメインを不安定にし、その結果、アンフォールディングの開始と Tmax, 1 が約 3℃ 低下します。Fab および CH3 のアンフォールディング事象を反映する主転移に関しては、ヒスチジンおよびコハク酸の緩衝液が最も安定化する力を有しており、Tmax, 2 は 82.66℃ です。主転移は、ホウ酸緩衝液中で最も安定性が低下しており、Tmax,2 は80.69℃です。当然のことながら、このサンプルセットの中でトラスツズマブに対して最も安定性の高い緩衝液製剤は、承認された医薬品の最終製剤に使用されるヒスチジン緩衝液です。製剤スクリーニングのデータ解析を容易にするため、NanoAnalyze ソフトウェアの自動 Tmax 検出は、タンパク質安定性スクリーニングで最大3つの転移を正確に検出することができます。ピーク検出アルゴリズムの精度を実証するために、ヒスチジン製剤バッファ中のトラスツズマブ 50 mg/mL の自動解析による Tmax,1 と Tmax,2 を、手動で特定したピーク温度とを比較しました。その結果を図3および表2に示します。自動分析では、対象温度範囲の指定を必要としない自動起動フック検出機能を使って、4次のベースライン多項式を適用した後、2つのピークが検出されました。
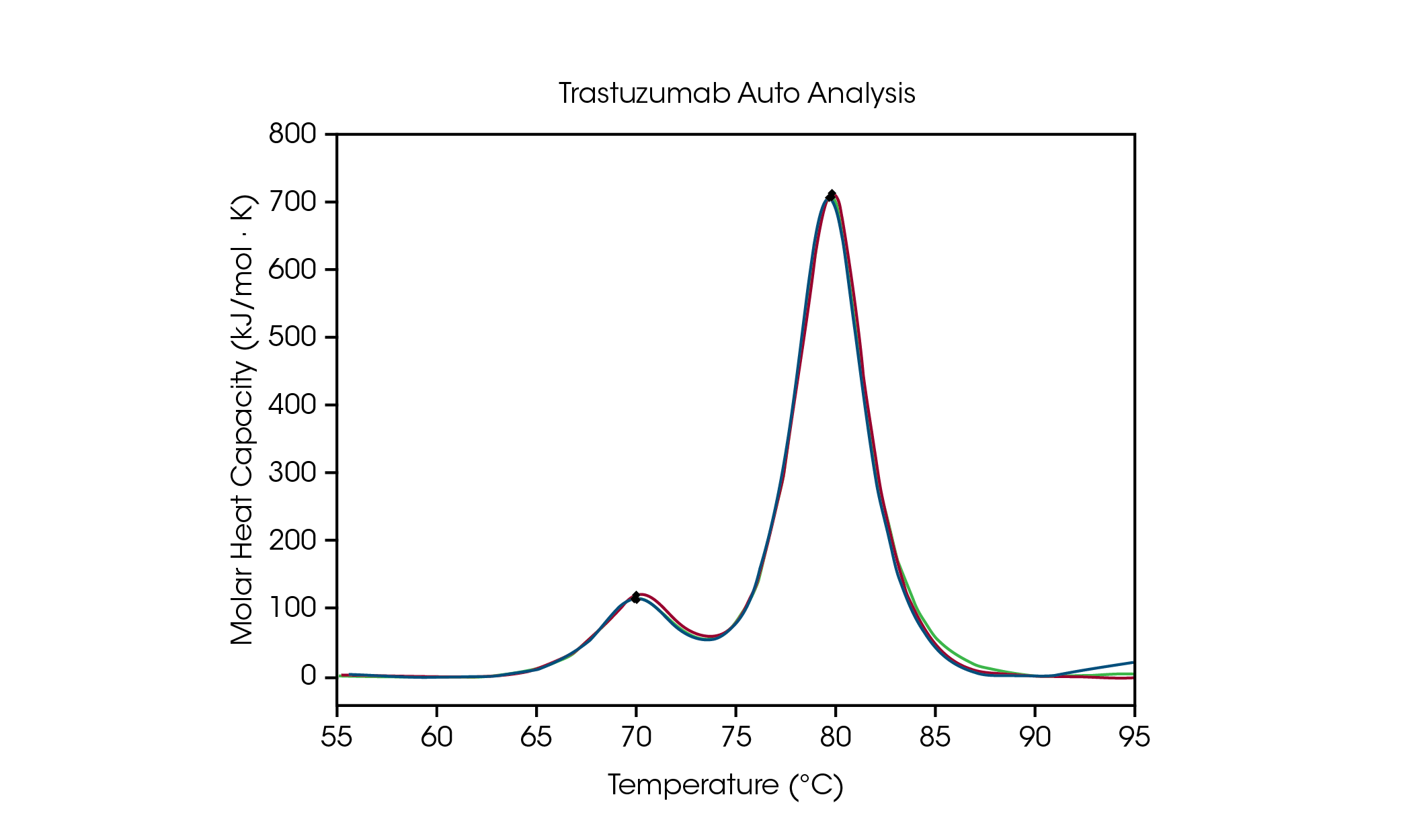
表2. トラスツマブに対し自動解析されたTmax検出値と手動による検出値の比較。
| サンプル | 自動 Tmax,1 (°C) | 手動 Tmax,1 (°C) | 自動 Tmax,2 (°C) | 手動 Tmax,2 (°C) |
|---|---|---|---|---|
| 複製 1 | 71.93 | 72.04 | 82.92 | 82.88 |
| 複製 2 | 71.81 | 71.93 | 82.76 | 82.75 |
| 複製 3 | 71.93 | 71.97 | 82.90 | 82.83 |
| 平均 | 71.89 ± 0.07 | 71.98 ± 0.06 | 82.86 ± 0.09 | 82.82 ± 0.07 |
CH2 ドメインのアンフォールディングでは自動解析により Tmax,1 71.89 °C が観察され、手動によるピーク分析では71.98 ° Cが得られました。主要な転移の自動 Tmax,2 は 82.86 °C 、手動ピーク分析では 82.82 ° Cでした。トラスツズマブに対する優れた再現性が観察されました。1つのサンプルにつき3回試験を行った結果、手動および自動の両方のピーク分析から得られた Tmaxは、機器の精度限界である ± 0.2 ° Cの範囲内でした。データを完全に把握するために、目視で確認することが常に推奨されます。このデータセットは、自動 DSC 分析機能が複数の転移サーモグラムで Tmaxを正確に検出できることを示しています。
配列変更のスクリーニング
タンパク質の変異は、タンパク質の構造と機能を最適化するための一般的な戦略であり、単一のアミノ酸の変更でもタンパク質全体の安定性に測定可能な影響を与える可能性があります。DSC は、変異がタンパク質の熱安定性に与える影響を把握し、バイオ医薬品開発パイプラインにおける意思決定の指針に役立てることができます。配列の変更が安定性に及ぼす影響の種類を説明するため、小パネルの人工抗体をスクリーニングし、タンパク質配列内の単一アミノ酸変異に起因する熱変性を評価しました(図4および表3)。
親抗体では、CH2、Fab、CH3 のアンフォールディング事象が Tmax 75.92℃での1つの主要な熱転移で見られました。親タンパク質からは、Tmax 75.52℃ で、短期熱安定性(変異1)に重大な影響を与えない単一のアミノ酸変異が見られました。しかし、単一アミノ酸変異がもう1つ加わると、タンパク質の安定性に重大な影響を与えることが示されました(変異2および変異3 )。変異2で明確なショルダーピークが観察され、これは Tmax,1 1 70.04 °C で見られた CH2ドメイン不安定化と対応している可能性が高く、また Tmax,2 75.14 ° C で親タンパク質に関係する主要な転移にわずかな変化が見られました。変異3は、CH2 ドメインの顕著な不安定化を引き起こし、その結果、Tmax,1 が 64.85 °Cの完全なアンフォールディングピークが発生しました。主要な転移の Tmax,2 は、75.29 ° C で比較的影響を受けませんでした。変異3で見られた著しい不安定性性からも明らかなように、配列の変更が常に同じ効果をもたらすわけではなく、むしろ変更の部位と新しいアミノ酸の物理化学的性質の両方に依存します。タンパク質の構造安定性を利用して、配列変更による所望の機能的利点を最適化することで、構造と機能の関係を把握しやすくなり、高度な治療法の開発を促進することができます。
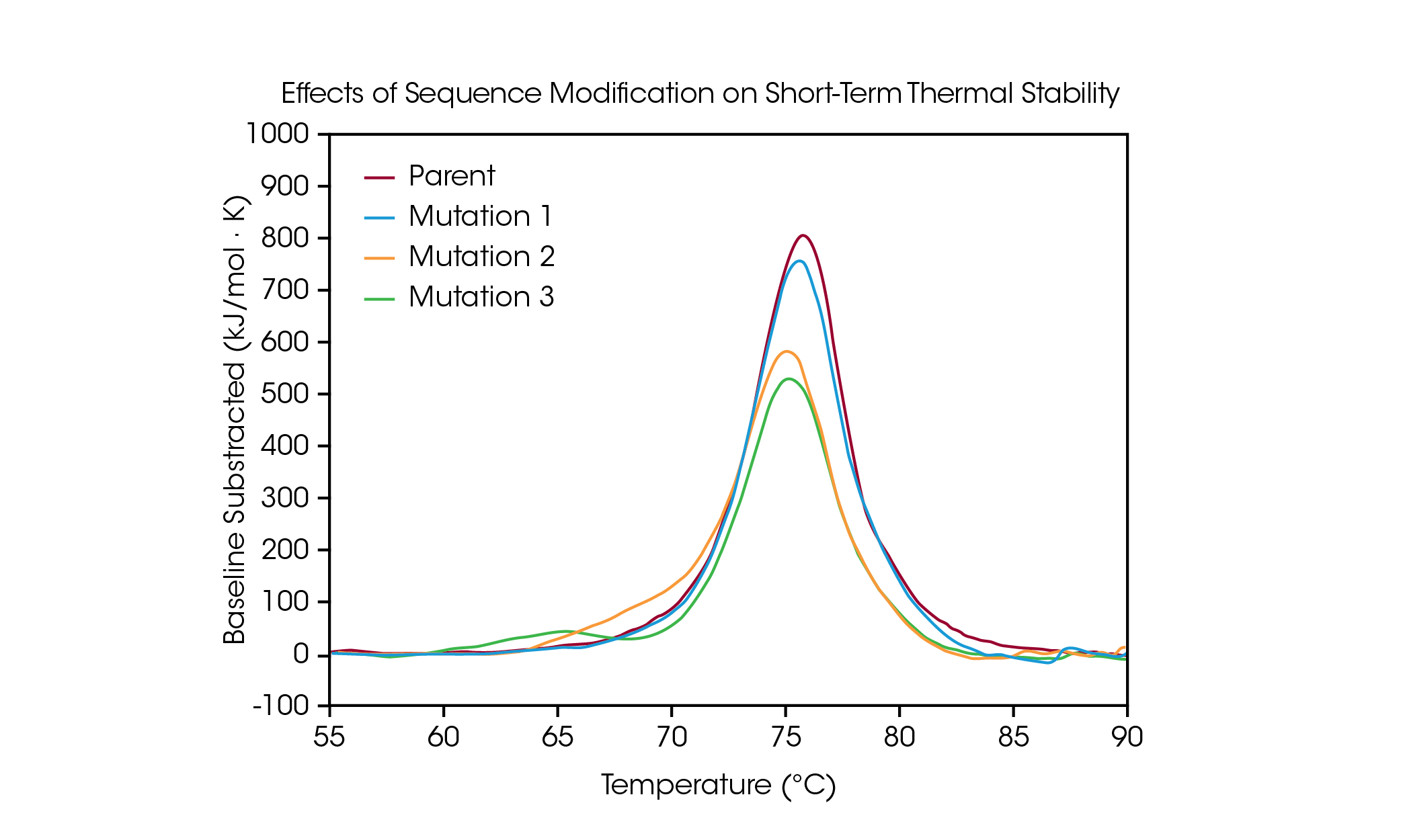
表3. 変異スクリーンにおける転移温度。平均 ± SD, n = 3. *Voigt モデルで特定。
| サンプル | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 親 | — | 75.92 ± 0.15 |
| 変異 1 | — | 75.52 ± 0.14 |
| 変異 2 | 70.04 ± 0.86* | 75.14 ± 0.06 |
| 変異 3 | 64.85 ± 0.05* | 75.29 ± 0.06 |
結論
溶液環境と配列変更が短期的な熱安定性に与える影響をスクリーニングすることは、高品質の医薬品の開発に不可欠です。TA Instruments RS-DSC は、最大 24 件のサンプルの同時試験により、熱安定性のハイスループットスクリーニングを可能にし、決定に要する時間を大幅に短縮します。このアプリケーションノートでは、複合した複数の転移がある抗体サンプルの正確かつ再現性の高い分析を行い、タンパク質全体の構造に対する緩衝成分と変異の影響を迅速に測定できることを実証しました。データ処理ソフトウェア、NanoAnalyze の新しいアルゴリズムにより、ハイスループットスクリーニングでアクセス可能な大量の熱データを容易に分析できるようになります。これらを総合すると、TA Instruments RS-DSC は、熱応力に対する耐性や製品の品質を理解し、規制当局の承認をサポートする上で重要な、抗体医薬品の安定性を評価する新しいプラットフォームを提供すると言えるでしょう。
参考文献
- V.T. Oi, T. M. Vuong, R. Hardy, J. Reidler, J. Dangl, L. A. Herzenberg and L. Stryer, “Correlation between segmental flexibility and effector function of antibodies,” Nature, vol. 307, pp. 136-140, 1984.
- P.L. Privalov and S. A. Potekhin, “Scanning microcalorimetry in studying temperature-induced changes in proteins,” Methods in Enzymology, vol. 131, pp. 5-51, 1986.
- J.Wen, Y. Jiang and L. Nahri, “Effect of Carbohydrate on Thermal Stability of Antibodies,” American Pharmaceutical Review, vol. 11, p. 98, 2008.
- “Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters,” ASTM E2603-15, 2023.
- “NanoDSC: What to Consider when Choosing a Baseline and Model,” TA Instruments, MC154.
- C.M. Johnson, “Differential scanning calorimetry as a tool for protein folding and stability,” Archives of Biochemistry and Biophysics, vol. 531, pp. 100-109, 2013.
- “Rapid Thermal Stability Screening of High Concentration Biologic Drugs,” TA Instruments, MC177.
- K.J. Arlotta, A. V. Gandhi, H.-N.Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, “In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution,” Antibodies, vol. 7, p. 6, 2018.
このアプリケーションノートの印刷用バージョンをダウンロードするにはこちらをクリックしてください。

