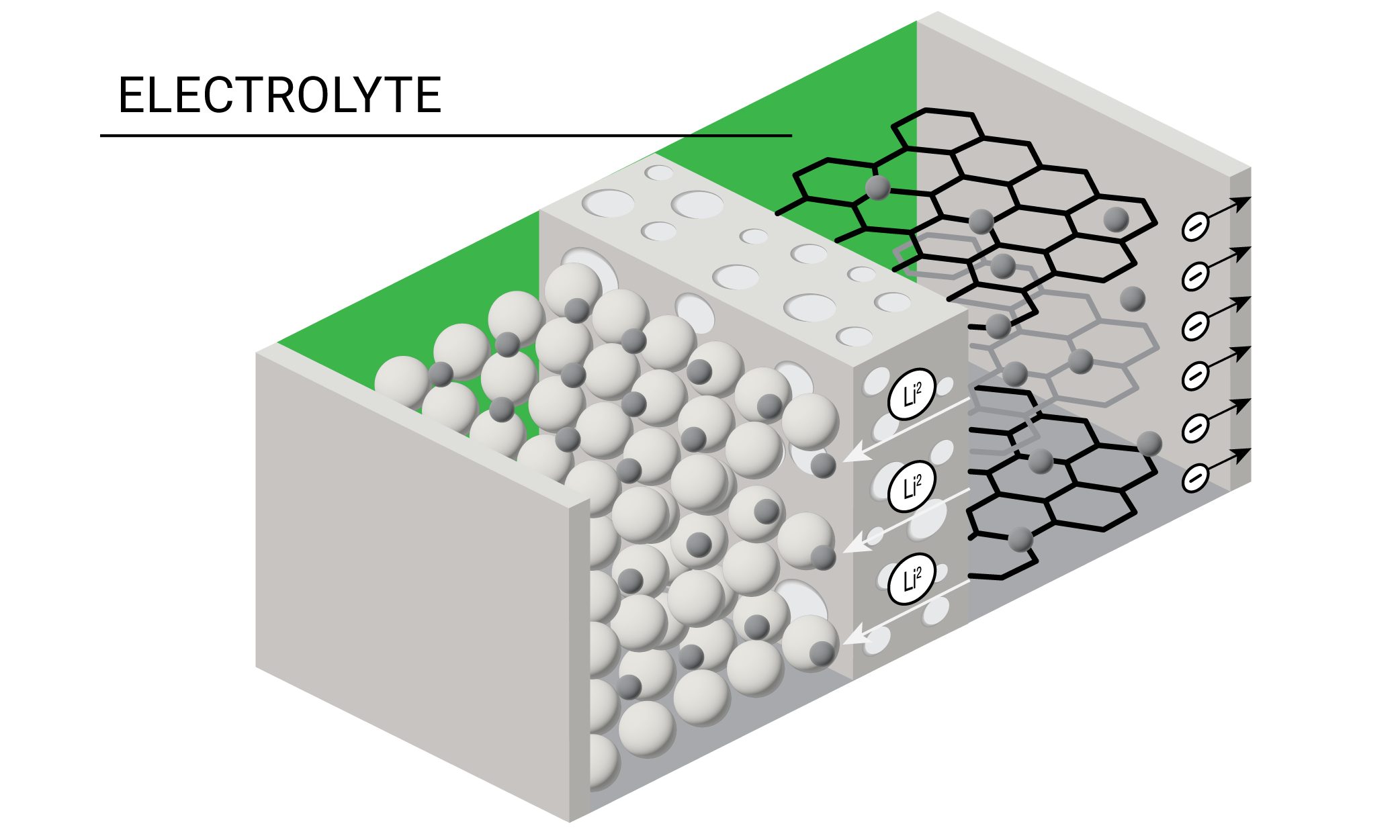
Eines der wichtigsten Batteriebestandteile ist der Elektrolyt, d. h. die leitfähige Lösung, in der positiv geladene Ionen während des Entladungsprozesses von der Kathode zur Anode transportiert werden. Elektrolyte in Lithium-Ionen-Batterien werden traditionell aus Lithiumsalz hergestellt, das in einer Mischung aus organischen Lösungsmitteln aufgelöst wird. Während der Batterieherstellung werden das Lösemittel und die Salzkomponenten auf der Anode reduziert und produzieren die feste Elektrolyt-Interphase (SEI), die beim Betrieb und der Sicherheit von Batterien eine wichtige Rolle spielt.
Heutzutage experimentieren Batterieforscher mit unterschiedlichen Formulierungen mit flüssigen, gelförmigen, polymeren und festen Elektrolyten. Die Entwicklung von geeigneten Elektrolyten erfordert ein ausgeglichenes Verhältnis von Viskosität, Leitfähigkeit, elektrochemischer Stabilität und Kosten. Die meisten Elektrolyten funktionieren gut bei niedrigen Temperaturen, haben jedoch selbst bei mittelhohen Temperaturen nur eine eingeschränkte Thermostabilität.
Batterieentwickler vertrauen bei der Messung der Thermostabilität von Elektrolyten auf die Thermoanalyse, um zu verhindern, dass bei ihrem Produkt Zersetzungsprozesse oder potenzielle Brände auftreten. Die Thermostabilität des Elektrolyten kann mithilfe der dynamischen Differenzkalorimetrie (DSC) und thermogravimetrischen Analyse (TGA) untersucht werden. Die Kombination dieser Methoden ermöglicht eine umfangreiche Analyse der thermischen Eigenschaften eines Elektrolyten. Mithilfe von Rheologie messen Ingenieure die Viskosität und produzieren Elektrolyt-Lösemittel mit optimaler Pumpbarkeit während der Herstellung.
Geräte und Testparameter
Material: Nichtwässrige Lösungen
Materialbeispiele: Karbonate und Elektrolytlösungen, Lithiumhexafluorophosphat (LiPF6)
Molekulare Zersetzung von Elektrolyten und Zusatzstoffen
Dynamische Differenzkalorimetrie
Elektrolytformulierung
- Schmelzen
- Kristallisierung
Thermostabilität
- Temperatur für thermisches Durchgehen
- Reaktionswärme
Thermogravimetrische Analyse
Thermostabilität
- Zersetzungstemperatur
Bestimmung der Bestandteile
- Volatiler Bestandteil
- Unreinheitsbestimmung
- Emissionsgasanalyse, TGA-MS, TGA-FTIR, TGA-GCMS
Analyse unter atmosphärischen Bedingungen
- Geeignet für den Betrieb in einem Isolator
- Umgebung mit Argon und Stickstoff als Spülgas
Pumpbarkeit, Transport
- Fließspannung
- (newtonsche, scherverdünnende, scherverdickende) Viskosität
- Viskoelastizität
Auswirkung von Lade-Entlade-Zyklen auf die Leitfähigkeit
- Viskosität
- Elektrorheologie
Analyse unter atmosphärischen Bedingungen
- Geeignet für den Betrieb in einem Isolator
- Umgebung mit Argon und Stickstoff als Spülgas
Anwendungsbeispiele
Welche thermalen Ereignisse führen zu thermischem Durchgehen („Runaway“)?
Es gibt zwar weiterhin noch offene Fragen in Bezug auf den in Batterien stattfindenden thermischen Runaway-Prozess, die derzeitige Kenntnislage spricht jedoch dafür, dass dieser Prozess durch die folgende Ereignisserie ausgelöst wird. Exotherme Reaktionen, die zu thermischem Durchgehen führen, interagieren auf zerstörerische Weise mit allen inneren Bestandteilen einer Lithium-Ionen-Batterie (LIB), da die Batterietemperatur kontinuierlich ansteigt. Einige Elemente fallen diesem Prozess frühzeitig zum Opfer, die meisten Elemente beschleunigen die Wärmeansammlung direkt im Moment ihres Versagen.
Die erste Komponente, mit der der Zusammenbruch beginnt, ist die Festelektrolyt-Interphase (Solid-Electrolyte Interphase, SEI), deren Zersetzung bei 80 °C–120 °C (176 °F–248 °F) beginnt. Zu diesem Zeitpunkt kann das thermische Durchgehen zwar noch verlangsamt werden, es lässt sich jedoch nicht mehr rückgängig machen, sobald die Anode in Kontakt mit dem Elektrolyten kommt. Exotherme Reaktionen, die auf der reaktiven Oberfläche der Anode auftreten, fügen dem System zusätzliche Wärme hinzu, bis die nächsten kritischen Temperaturen erreicht sind.
Die nächste betroffene Komponente ist der Separator. Beim Versagen des Separators gibt es zwei Schritte: Bei ungefähr 120 °C –150 °C (248 °F–302 °F) beginnt der Separator zu schmelzen und er verursacht einen leichten Kurzschluss, gefolgt von einem schwereren internen Kurzschluss bei etwa 220 °C –250° C (428 °F–482 °F), bei dem sich der Separator zersetzt.
Die nachfolgenden Reaktionen laufen schnell ab und folgen direkt auf den vorherigen Temperaturbereich. Wenn die Zersetzung des Kathodenmaterials, des Bindemittels und des Elektrolyts beginnt, erhöht sich die Temperatur der Batteriezelle drastisch auf Temperaturen von ungefähr 800 °C (1472 °F). Bei diesen Reaktionen werden Gasprodukte erzeugt, die den Druck in der LIB weiter erhöhen.
Die erste Komponente, mit der der Zusammenbruch beginnt, ist die Festelektrolyt-Interphase (Solid-Electrolyte Interphase, SEI), deren Zersetzung bei 80 °C–120 °C (176 °F–248 °F) beginnt. Zu diesem Zeitpunkt kann das thermische Durchgehen zwar noch verlangsamt werden, es lässt sich jedoch nicht mehr rückgängig machen, sobald die Anode in Kontakt mit dem Elektrolyten kommt. Exotherme Reaktionen, die auf der reaktiven Oberfläche der Anode auftreten, fügen dem System zusätzliche Wärme hinzu, bis die nächsten kritischen Temperaturen erreicht sind.
Die nächste betroffene Komponente ist der Separator. Beim Versagen des Separators gibt es zwei Schritte: Bei ungefähr 120 °C –150 °C (248 °F–302 °F) beginnt der Separator zu schmelzen und er verursacht einen leichten Kurzschluss, gefolgt von einem schwereren internen Kurzschluss bei etwa 220 °C –250° C (428 °F–482 °F), bei dem sich der Separator zersetzt.
Die nachfolgenden Reaktionen laufen schnell ab und folgen direkt auf den vorherigen Temperaturbereich. Wenn die Zersetzung des Kathodenmaterials, des Bindemittels und des Elektrolyts beginnt, erhöht sich die Temperatur der Batteriezelle drastisch auf Temperaturen von ungefähr 800 °C (1472 °F). Bei diesen Reaktionen werden Gasprodukte erzeugt, die den Druck in der LIB weiter erhöhen.
TGA-Thermogramm, das die thermische Instabilität des Materials einer Graphitanode zeigt .
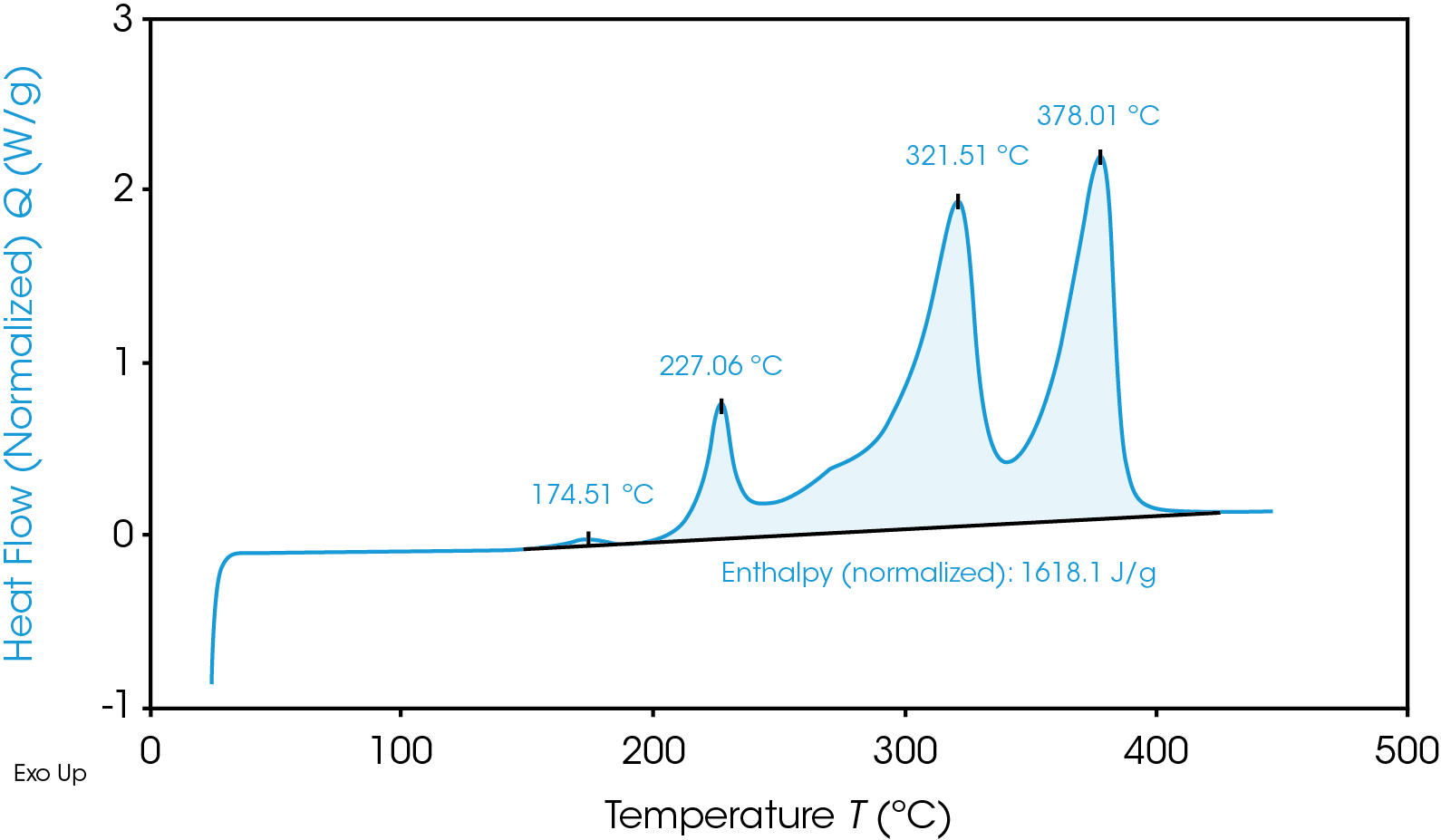
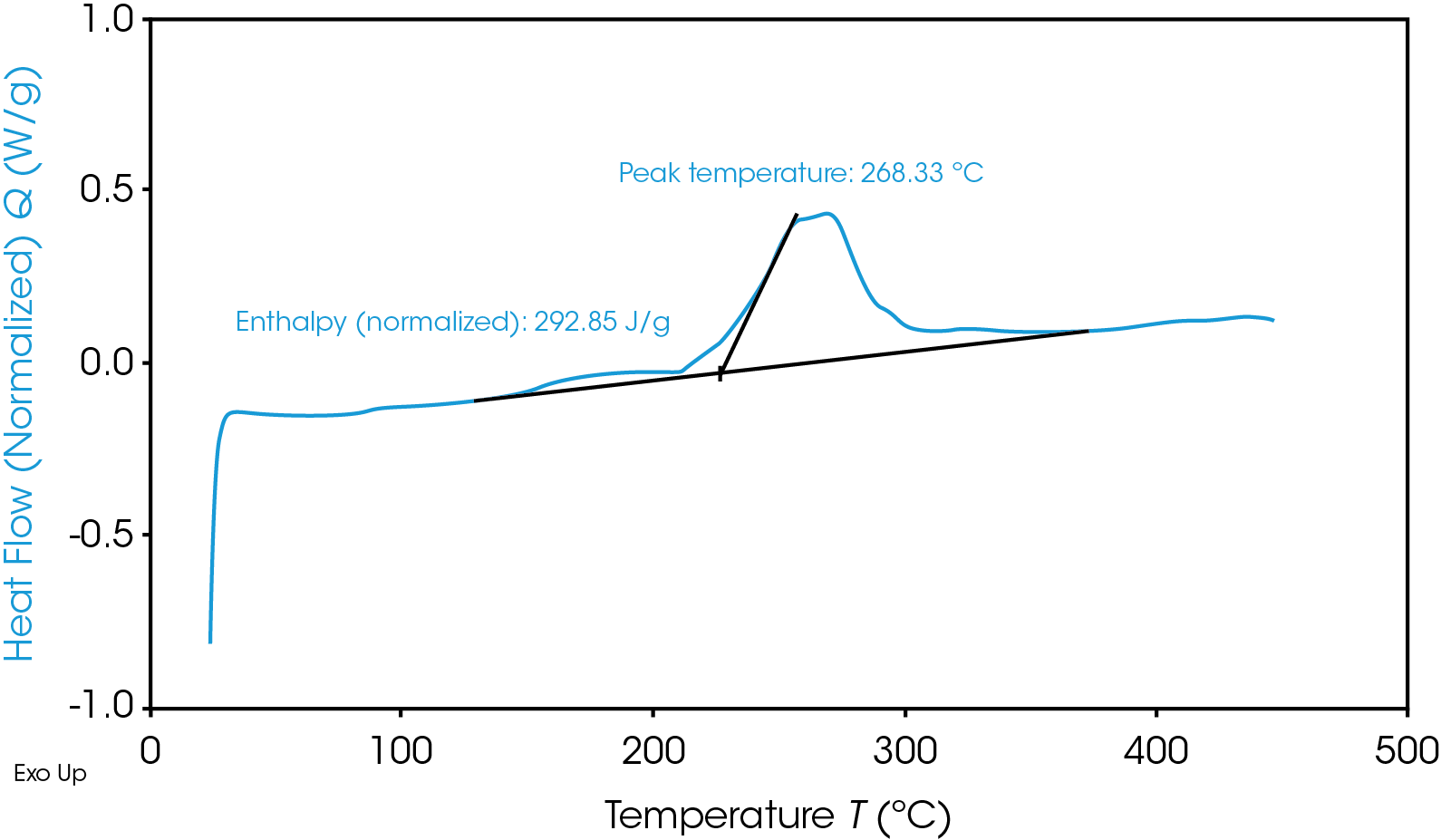
Neben der schnellen Wärmentwicklung entsteht bei den Kationenreaktionen zudem als gefährliches Nebenprodukt entzündlicher Sauerstoff. Je nach den exakten Bedingungen ist das unmittelbare Ergebnis entweder „Wärme + Sauerstoff = Feuer“ oder „Wärme + Gas = Ruptur/Explosion“. Natürlich sind nicht alle Materialien gleich und befinden sich weiter oben oder unten innerhalb dieser Bereiche – oder in der Zukunft sogar außerhalb dieser Bereiche. Daher ist es wichtig, die sicherste Materialauswahl für eine gegebene Batterie zu treffen und das Material ausreichend zu testen.
Um ein thermisches Durchgehen zu vermeiden und Batteriematerialien mit optimalen Wärmetoleranzen auszuwählen, setzen Batterieforscher dynamische Differenzkalorimetrie (DSC) und thermogravimetrische Analysen (TGA) ein:
DSC: DSC misst den ein- und ausgehenden Wärmefluss in ein/von einem Material als Funktion der Temperatur oder Zeit. Phasenänderungen unterbrechen die Beziehung zwischen Temperaturänderung und absorbierter oder freigesetzter Wärme in Bezug auf die Wärmekapazität und werden als grafisches Ergebnis dargestellt. Dies ermöglicht das Testen bei verschiedenen Bedingungen, von Betriebstemperatur bis hin zu thermischem Fehlgebrauch.
TGA: TGA misst die Masse einer Probe als Funktion der Temperatur oder Zeit. Generell lässt sich feststellen, dass thermostabile Materialien eine höhere Temperatur erreichen können, bevor eine Massenänderung auftritt.
Beantworten Sie die folgenden Fragen anhand ihrer DSC-Ergebnisse:
- Die Schmelztemperatur des Materials, Tm
- Die Glasübergangstemperatur des Materials, Tg
- Die niedrigste Phasenänderungstemperatur verschiedener Materialien, aus denen die Batterie besteht.
Beantworten Sie die folgenden Fragen anhand ihrer TGA-Ergebnisse:
- Die Temperatur, bei der die Zersetzung eines Materials beginnt.
- Die bei einer gegebenen Temperatur durch thermische oder oxidative Zersetzung verlorengegangene Probenmasse.
- Die Rate der Zersetzungsreaktionen (sowohl oxidativ als auch thermisch induziert) bei einer gegebenen Temperatur.
- Die maximale thermisch stabile Temperatur der unterschiedlichen Materialien, aus denen die Batterie besteht.





