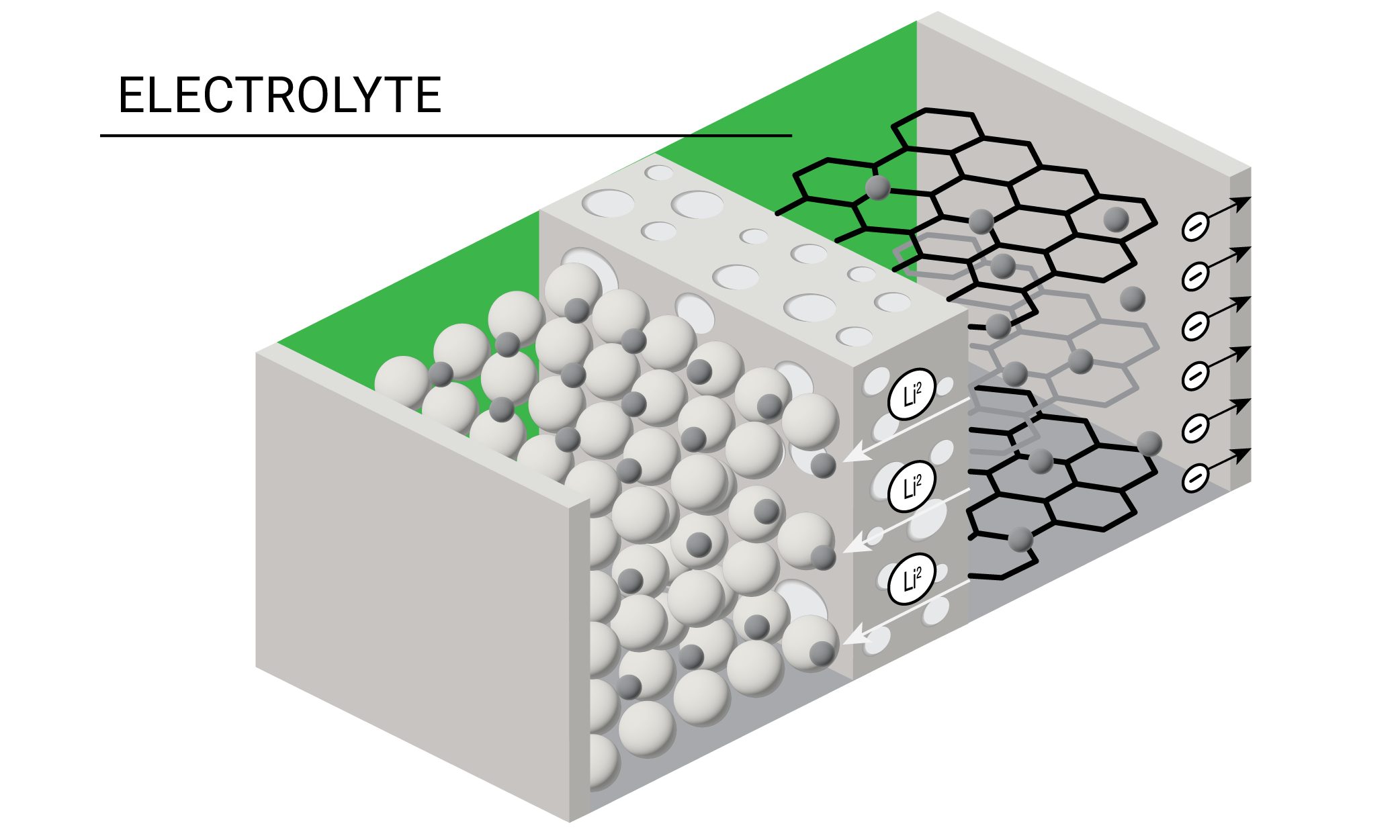
Uno de los componentes más críticos de la batería es el electrolito, que es la solución conductora que transporta iones con carga positiva del cátodo al ánodo durante el proceso de descarga. Los electrolitos de las baterías de iones de litio tradicionalmente consisten en una sal de litio disuelta en una mezcla de solventes orgánicos. Durante la formación de la batería, los componentes de solvente y sal del electrolito se reducen en el ánodo para producir la interfase de electrolito sólido (solid electrolyte interphase, SEI), que desempeña un papel crucial en el funcionamiento y la seguridad de la batería.
Los investigadores de baterías están experimentando con diferentes formulaciones de electrolitos en líquido, gel, polímero y de estado sólido. El diseño de electrolitos exitosos exige equilibrar la viscosidad, la conductividad, la estabilidad electroquímica y el costo. Casi todos los electrolitos pueden funcionar bien a bajas temperaturas, pero tienen una estabilidad térmica restrictiva incluso a temperaturas moderadas.
Los desarrolladores de baterías confían en el análisis térmico para medir la estabilidad térmica de los electrolitos y asegurar que sus diseños eviten la degradación, e incendios potenciales. La estabilidad térmica de los electrolitos se puede investigar con calorimetría diferencial de barrido (DSC) y análisis termogravimétrico (TGA), y juntos estos métodos ofrecen un análisis integral de las propiedades térmicas de un electrolito. La reología permite a los ingenieros medir la viscosidad y producir solventes de electrolitos con una bombeabilidad óptima durante la fabricación.
Instrumentos y parámetros de prueba
Material: solventes no acuosos
Ejemplos de materiales: carbonatos y soluciones electrolíticas, hexafluorofosfato de litio (LiPF6)
Degradación molecular de electrolitos y aditivos
Calorimetría diferencial de barrido
- Formulación de electrolitos
- Fusión
- Cristalización
- Estabilidad térmica
- Temperatura de fuga térmica
- Calor de la reacción
- Estabilidad térmica
- Temperatura de descomposición
- Determinación de composición
- Contenido volátil
- Determinación de impureza
- Análisis de gas evolucionado,
TGA-MS, TGA-FTIR, TGA-GCMS
- Análisis atmosférico
- Compatible con operación de guantera
- Entorno purgado con argón y nitrógeno
- Capacidad de bombeo, transporte
- Límite elástico
- Viscosidad (newtoniana, adelgazamiento de capas, engrosamiento de capas)
- Viscoelasticidad
- Efecto de ciclos de carga-descarga en la conductividad
- Viscosidad
- Electro-reología
- Análisis atmosférico
- Compatible con operación de guantera
- Entorno purgado con argón y nitrógeno
Ejemplos de aplicación
¿Qué eventos térmicos conducen a la fuga térmica?
Si bien quedan preguntas acerca del proceso de fuga térmica en las baterías, la comprensión actual sugiere que se inicia por la serie de eventos que siguen. Las reacciones exotérmicas que conducen a la fuga térmica tienen una interacción destructiva con cada componente interno de una batería de iones de litio (Lithium-Ion Battery, LIB) conforme continúa el aumento de la temperatura de la batería; algunos elementos se descomponen en etapas tempranas, mientras que en casi todos la acumulación de calor se acelera directamente a medida que fallan.
El primer componente que comienza a descomponerse es la interfaz de electrolito-sólido (Solid-Electrolyte Interphase, SEI), que por lo general comienza alrededor de los 80 °C a 120 °C (176 °F a 248 °F). En este punto, la fuga térmica se puede lentificar, pero ya no es reversible una vez que el ánodo queda expuesto al electrolito. Las reacciones exotérmicas que ocurren en la superficie del ánodo reactivo agregan más calor al sistema hasta que alcanza las siguientes temperaturas críticas.
El separador es el siguiente componente afectado, y falla en dos etapas. A alrededor de 120 °C a 150 °C (248 °F a 302 °F) el separador comienza a fundirse y causa un pequeño cortocircuito, seguido de un cortocircuito interno más grave cuando el separador se rompe cerca de 220 °C a 250 °C (428 °F a 482 °F).
Las reacciones siguientes ocurren con rapidez y de manera directa después del rango de temperatura anterior; el material del cátodo, el aglutinante y el electrolito comienzan a descomponerse, lo cual produce un aumento drástico de la temperatura de la celda de la batería a temperaturas de aproximadamente 800 °C (1472 °F). Estas reacciones tienen productos gaseosos que aumentan la presión dentro de la LIB.
El primer componente que comienza a descomponerse es la interfaz de electrolito-sólido (Solid-Electrolyte Interphase, SEI), que por lo general comienza alrededor de los 80 °C a 120 °C (176 °F a 248 °F). En este punto, la fuga térmica se puede lentificar, pero ya no es reversible una vez que el ánodo queda expuesto al electrolito. Las reacciones exotérmicas que ocurren en la superficie del ánodo reactivo agregan más calor al sistema hasta que alcanza las siguientes temperaturas críticas.
El separador es el siguiente componente afectado, y falla en dos etapas. A alrededor de 120 °C a 150 °C (248 °F a 302 °F) el separador comienza a fundirse y causa un pequeño cortocircuito, seguido de un cortocircuito interno más grave cuando el separador se rompe cerca de 220 °C a 250 °C (428 °F a 482 °F).
Las reacciones siguientes ocurren con rapidez y de manera directa después del rango de temperatura anterior; el material del cátodo, el aglutinante y el electrolito comienzan a descomponerse, lo cual produce un aumento drástico de la temperatura de la celda de la batería a temperaturas de aproximadamente 800 °C (1472 °F). Estas reacciones tienen productos gaseosos que aumentan la presión dentro de la LIB.
Termograma de TGA que pone de relieve la inestabilidad térmica del material del ánodo de grafito
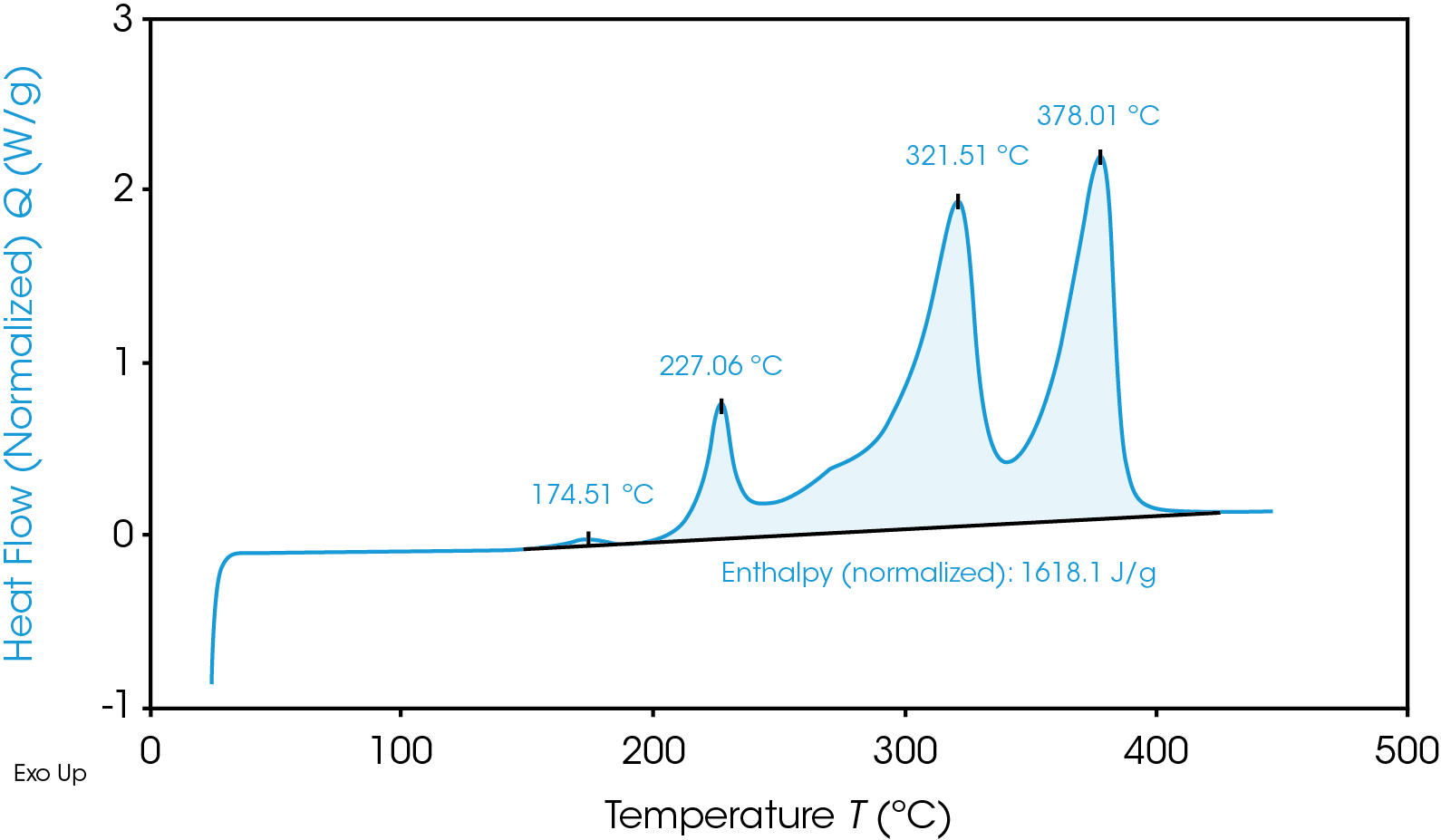
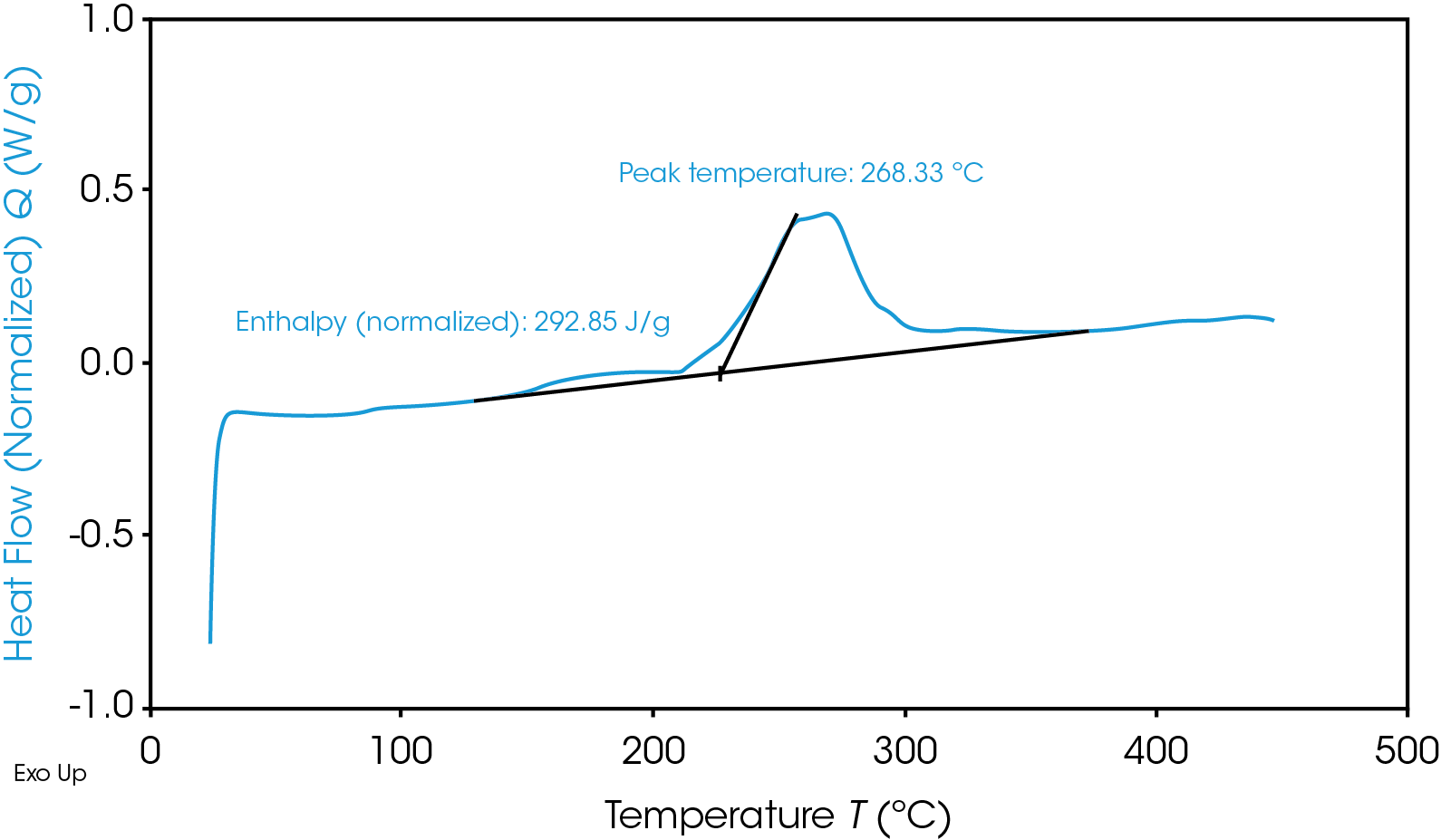
Aparte de la rápida generación de calor, las reacciones catódicas tienen un subproducto desastroso de oxígeno que es inflamable. Dependiendo de las condiciones exactas, el resultado inmediato es «calor + oxígeno = fuego» o «calor + gas = rotura/explosión». Por supuesto, no todos los materiales son iguales y pueden caer por arriba o por debajo de estos rangos, o incluso fuera de estas temperaturas en el futuro – de modo que es esencial hacer la elección más segura posible de materiales para una batería determinada, con las pruebas adecuadas.
A fin de evitar la fuga térmica y seleccionar materiales de batería con tolerancias al calor óptimas, los investigadores de baterías recurren a la calorimetría diferencial de barrido (Differential Scanning Calorimetry, DSC) y al análisis termogravimétrico (Thermogravimetric Analysis, TGA):
DSC: la DSC mide el flujo de calor hacia adentro o hacia afuera de un material en función de la temperatura o el tiempo. Los cambios de fase interrumpen la relación de capacidad calorífica entre el cambio de temperatura y el calor absorbido o liberado y son visibles en el gráfico que se produce. Permite realizar pruebas en una amplia variedad de condiciones que van desde la temperatura de funcionamiento segura hasta el abuso térmico.
TGA: el TGA mide la masa de una muestra en función de la temperatura o el tiempo. En términos generales, un material más estable desde el punto de vista térmico puede alcanzar una temperatura más alta antes de que ocurra cualquier cambio de la masa.
Responda las preguntas que siguen con los resultados de su DSC:
- La temperatura de fusión del material, Tm
- La temperatura de transición vítrea del material, Tg
- La temperatura de cambio de fase más baja de los diversos materiales que componen la batería.
Responda las preguntas que siguen con los resultados de su TGA:
- La temperatura a la cual comienza la descomposición de un material.
- La cantidad de masa de muestra que se pierde por descomposición térmica u oxidativa a una temperatura determinada.
- La tasa de reacciones de descomposición (tanto oxidativas como térmicamente inducidas) a una temperatura dada.
- La temperatura máxima térmicamente estable de los diversos materiales que componen la batería.





