Palabras clave: microcalorimetría, electroquímica, calor, batería, Li-ion, primaria, secundaria, autodescarga, reacción parásita.
MC158-ES
ANTECEDENTES
La energía eléctrica impulsa nuestras vidas, ya que puede convertirse fácilmente en calor, luz, enlaces químicos o trabajo mecánico cuando lo necesitemos. Cada vez más aplicaciones requieren que la electricidad se retire de la red, como ocurre con los teléfonos celulares, los vehículos y diversos electrodomésticos. Muchos de estos dispositivos requieren grandes cantidades de energía almacenada en espacios compactos. Esto ha llevado a una amplia innovación y desarrollo de tecnologías de las baterías que se enfoca en ampliar los ciclos de carga de las celdas recargables, la vida útil y la seguridad. No es una exageración que la batería de iones de litio, en sus diversas químicas y formas, sea clave para el desarrollo de vehículos impulsados por baterías y diversos dispositivos portátiles. De hecho, los inventores de la celda de iones de litio recibieron el Premio Nobel de Química del 2019 con la motivación de “haber creado un mundo recargable”. Se están explorando diferentes químicas para celdas, mientras que las celdas de iones de litio dominan actualmente las actividades de investigación y desarrollo y el mercado de baterías recargables.
Los procesos electroquímicos que tienen lugar en las baterías, ya sea bajo carga o en condiciones de estar cargando, dan lugar a un intercambio de calor con el entorno. El trabajo que se realiza a medida que las especies cargadas fluyen internamente en una celda da lugar a la generación de calor, así como a los procesos redox en el ánodo y el cátodo y varias reacciones secundarias parasitarias que son la causa de limitación de la vida útil de una batería.
Los procesos que provocan cambios en la materia suelen ir acompañados de un intercambio de calor con el entorno. Cuanto más rápida sea la velocidad de un cambio químico o físico, mayor será la velocidad de generación de calor. La calorimetría isotérmica es hoy una técnica establecida para obtener información sobre una amplia gama de fenómenos físicos, químicos o biológicos. En un microcalorímetro isotérmico, la evolución del calor se controla continuamente en tiempo real mientras la muestra medida se mantiene a una temperatura constante.
La calorimetría isotérmica se ha utilizado durante varias décadas para controlar la autodescarga en baterías predominantemente primarias, como las utilizadas en marcapasos, Hansen y Hart (1978). Durante la última década se ha observado un fuerte aumento en el interés de la microcalorimetría isotérmica en la investigación y el desarrollo de baterías, tanto en el mundo académico como en la industria. Este aumento de actividad se ha enfocado en gran medida en las baterías secundarias, especialmente las de iones de litio.
El tipo de microcalorímetros generalmente utilizados son del tipo de conducción de calor o flujo de calor con recipientes de muestra extraíbles que contienen la muestra de la batería en estudio; consulte Suurkuusk et al (2017) para obtener una descripción detallada de un sistema microcalorimétrico moderno. Los calorímetros están montados en un entorno altamente regulado con estabilidad de temperatura en la escala μK. A medida que una muestra produce o absorbe calor, la energía térmica fluye entre la muestra y el entorno del termostato, manteniendo constante la temperatura de la muestra. El flujo de calor se mide mediante sensores termoeléctricos colocados entre la muestra y su entorno de temperatura regulada.
El objetivo de esta nota es dar una visión general de la microcalorimetría isotérmica en la investigación, el desarrollo y el control de calidad de baterías con el fin de ilustrar la versatilidad y dar una idea de las posibilidades de la microcalorimetría isotérmica.
PRODUCCIÓN DE CALOR Y PROCESOS DE BATERÍA
Cuando una batería se carga o descarga, se produce calor debido a una variedad de eventos que producen o consumen calor. Dahn et al (1985) estudiaron el intercalado de Li a LixMo6Se8 en una celda electroquímica por calorimetría isotérmica. Proporcionaron un modelo que consideraba las diversas contribuciones a la producción total de calor para una celda recargable de iones de litio ilustrada simplemente por los siguientes términos.
PTotal = PPolarization + PEntropic + PParasitic (1)
Su trabajo tuvo como objetivo dilucidar el término entrópico reversible para estimar experimentalmente el cambio de entropía del compuesto de intercalado como una función de la carga de litio, x. El objetivo de su trabajo era validar experimentalmente modelos teóricos de red de gases para la intercalación.
El término de polarización, que es exotérmico, incluye cualquier proceso responsable de la desviación del voltaje de la celda con respecto al voltaje termodinámico. Un ejemplo es el flujo de especies cargadas como electrones o iones dentro de la celda. El término reversible constituye el cambio de entropía de la celda durante la carga o descarga, por ejemplo, cambios del estado termodinámico de un material de electrodo con el número de iones de Li intercalados. Las reacciones parasíticas son generalmente cambios irreversibles en la química de la celda que limitan la vida útil de la batería. La cantidad de calor producida debido a tales reacciones es una medida directa de hasta qué punto limitan la vida útil de una batería.
Posteriormente, el modelo se utilizó para racionalizar un método para la cuantificación de reacciones parasíticas en celdas de iones de litio mediante el uso de microcalorimetría isotérmica, Krause et al (2012).
AUTODESCARGA
Las baterías en condiciones de circuito abierto tienden a generar flujos de calor de bajo nivel debido a procesos de autodescarga. La autodescarga puede definirse como la pérdida de energía que reduce la vida útil de una batería. Si bien esto es relevante para las baterías primarias, las baterías secundarias también sufren una autodescarga que, en parte, es irreversible y en parte reversible al recargar la celda. Aunque los mecanismos de los procesos de autodescarga no se comprenden muy bien para muchos tipos de celdas, es razonable suponer que cuanto mayor sea la tasa de generación de calor para tipos de baterías similares, más corta será la vida útil o el ciclo de recarga de la batería.
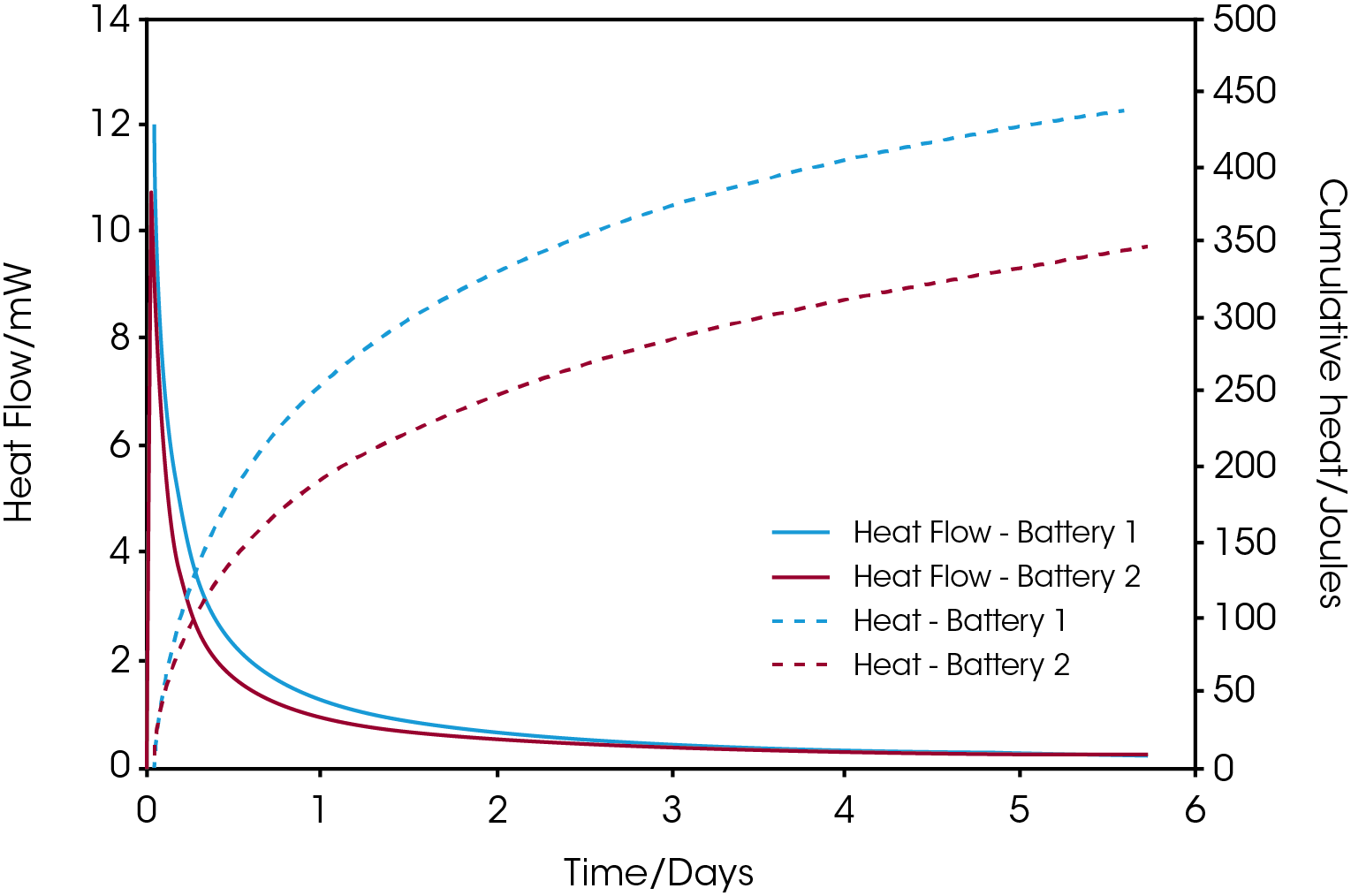
La Figura 1 muestra el flujo de calor de autodescarga y las curvas de calor acumulado para baterías comerciales AAA NiMH de dos fabricantes diferentes. Las baterías se cargaron al 100% antes de introducirlas en el calorímetro a 25 °C. Se ve que la batería 1 muestra una tasa de descarga más alta durante los 3 días iniciales, donde después el flujo de calor de las dos baterías termina aproximadamente al mismo nivel. La diferencia en energía liberada entre las dos baterías después de 5.7 días es de solo menos de 100 joules, como lo revelan las curvas de calor acumulado.
Roth (1999) estudió la autodescarga de celdas de iones de litio como una función de la temperatura y el estado de carga (SOC) con dos compuestos de óxido metálico de intercalación catódica diferentes. Se encontró una fuerte dependencia de los procesos de autodescarga del COS en el rango de 0-100% y de la temperatura en el intervalo de 40-70 °C. Las mediciones microcalorimétricas revelaron una mayor reactividad de las celdas con LixNi0.8Co0.2O2 en comparación con cátodos de LixCoO2. Además, se encontró correlación entre la propensión a la fuga térmica y el flujo de calor medido en el intervalo de temperatura estudiado.
Hansen y Hart (1978) caracterizaron las pérdidas de energía interna de las baterías de marcapasos con el propósito de introducir un método rápido y confiable de garantía de calidad para eliminar las baterías con tasas de autodescarga anormalmente altas. Distinguieron con éxito baterías con tasas de autodescarga altas y bajas probando tipos de celdas de MgO/Zn y Li-yodo. También observaron que la antigüedad de la batería influye en el flujo de calor de autodescarga, que debe tenerse en cuenta al interpretar los datos calorimétricos.
Hoy en día, la calidad de las baterías de los marcapasos se puede probar en un microcalorímetro isotérmico; estas pruebas a menudo se realizan en el dispositivo médico, es decir, el propio marcapasos. El flujo de calor de un dispositivo pasivo debe ser muy bajo, inferior a 20 μW y, más a menudo, inferior a 10 μW.
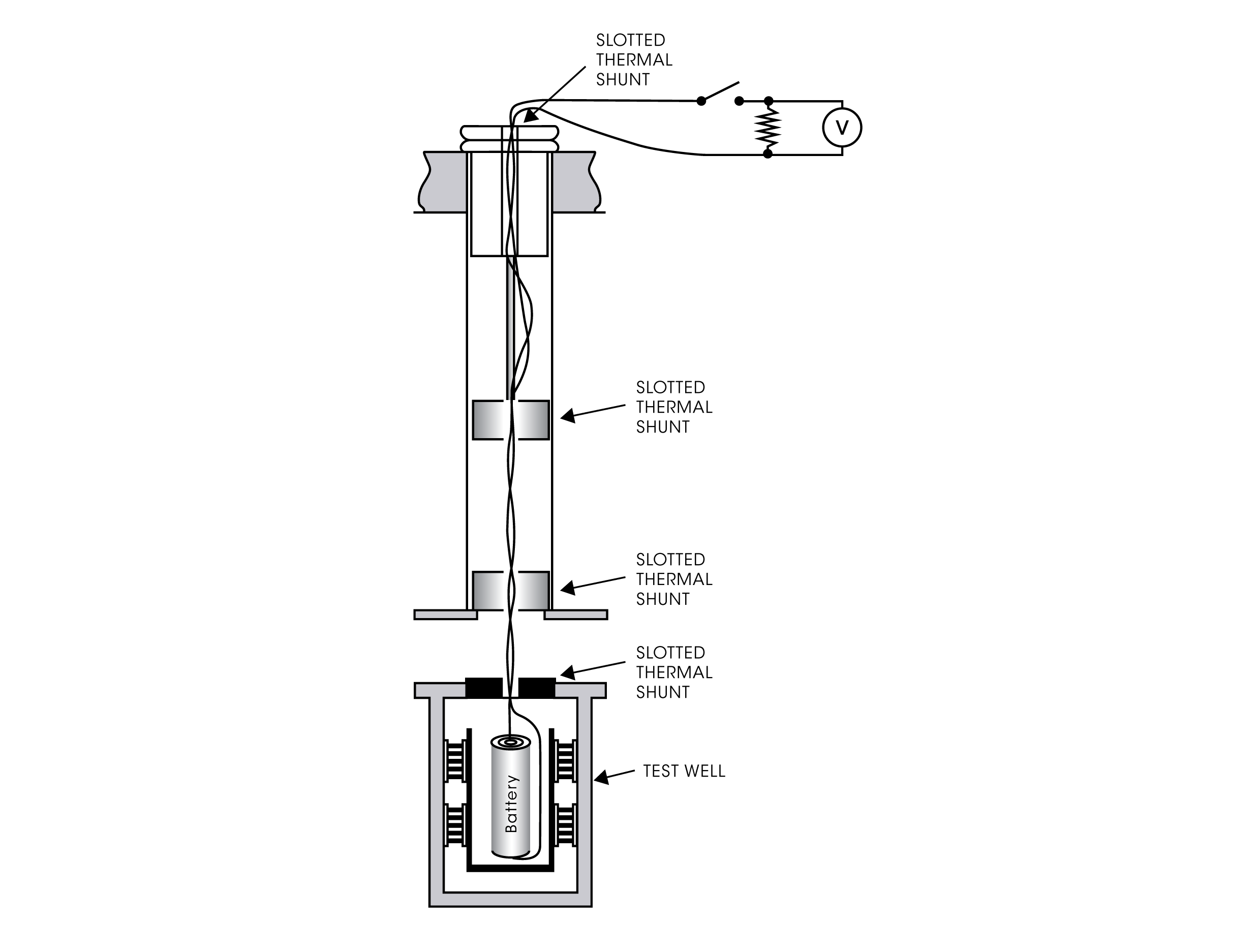
MEDICIONES EN CIRCUITO CERRADO
Con un sistema microcalorimétrico moderno, como el TAM IV o el TAM XL, son posibles varias configuraciones experimentales para medir los procesos de la batería en condiciones de circuito cerrado. Las ampolletas de inserción especialmente diseñadas que sostienen la batería u otra muestra electrónica permiten la conexión de cables eléctricos. Los cables se sacan del calorímetro para conectarlos a un dispositivo electrónico colocado externamente, por ejemplo, una resistencia y/u otro dispositivo electrónico como una fuente de alimentación, un voltímetro, etc. De este modo, la producción de calor en la batería se puede medir durante los ciclos de carga/descarga.
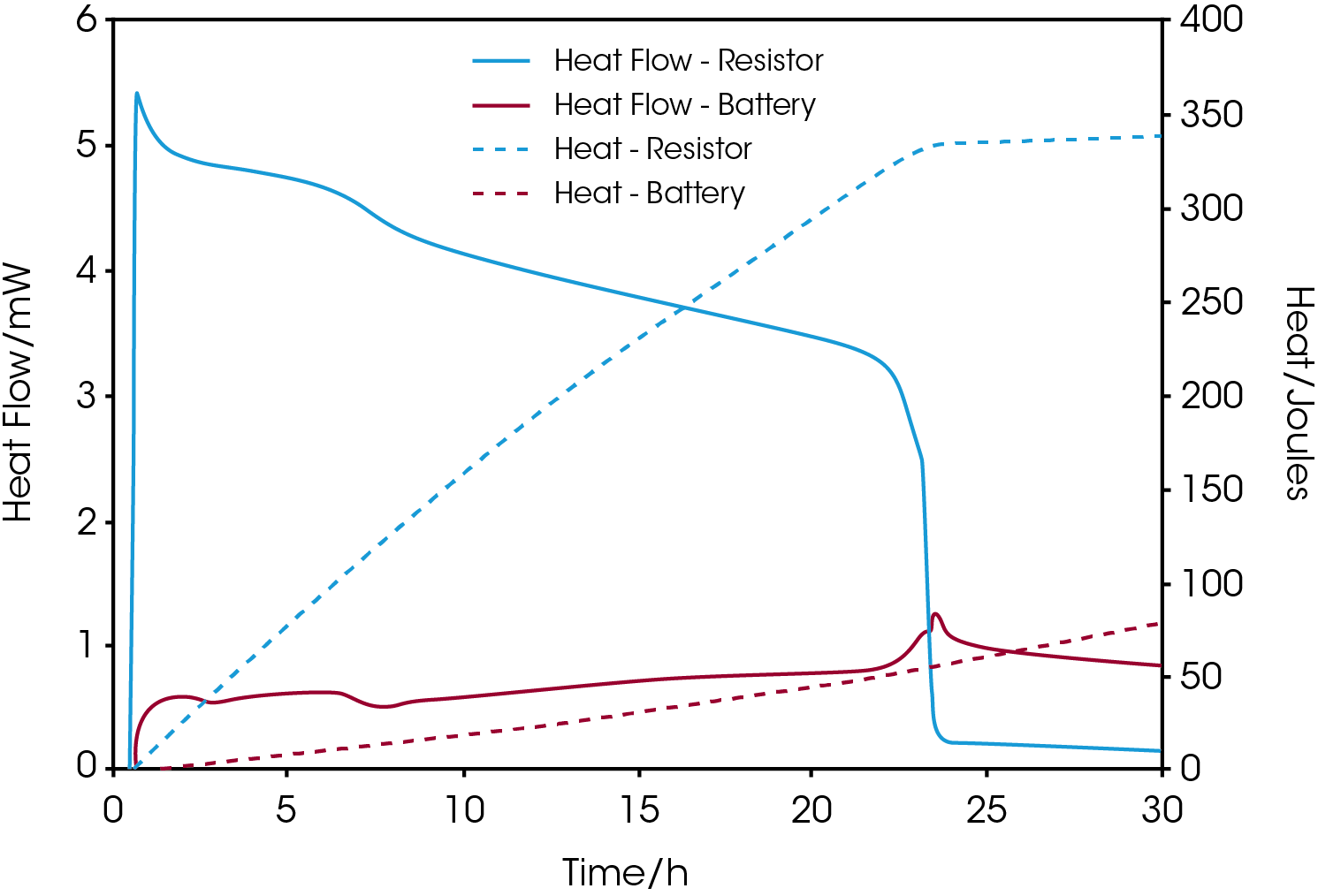
Con una plataforma calorimétrica multicanal, como TAM IV, se pueden utilizar dos o más calorímetros de forma simultánea e independiente para medir el flujo de calor desde un dispositivo electrónico, como una resistencia, además de la batería. Estas mediciones completan el presupuesto energético en términos de producción de calor. La Figura 3 muestra el flujo de calor y el calor acumulado de la medición de una celda de botón de óxido de plata comercial conectada a una resistencia de 380 ohmios colocada en un segundo calorímetro.
A medida que la corriente a través de la resistencia disminuye con el tiempo conforme cae el voltaje, en las gráficas se observa un aumento concomitante de la producción de calor de la batería. Cuando el flujo de calor de la resistencia cae hacia cero después de aproximadamente 23 horas de medición, la cantidad total de calor liberada es de aproximadamente 330 joules, correspondientes a un contenido de energía residual de 75 mAh.
El término “calorimetría electroquímica” se ha adoptado para describir la combinación de microcalorimetría isotérmica con un voltímetro de alta resolución y una fuente de corriente de precisión para estudios de ciclos de carga/descarga en diferentes condiciones de carga, Krause et al (2012). Además de correlacionar los datos calorimétricos con las eficiencias coulómbicas, estas configuraciones experimentales permiten separar y cuantificar las diferentes contribuciones al flujo de calor total según la ecuación 1.
REACCIONES PARASÍTICAS
Krause et al (2012) describieron un método para separar los eventos de calor parasíticos de la producción total de calor y así cuantificar las reacciones parasíticas. El enfoque consistió en medir ciclos completos de carga/descarga. La contribución de la polarización se obtuvo de la histéresis de voltaje integrada y luego se pudo restar del flujo de calor medido durante todo un ciclo de carga/descarga. Al darse cuenta de que el flujo de calor reversible de un ciclo se cancela cuando se integra durante todo el ciclo, el calor restante es el resultado de reacciones parasíticas irreversibles después de restar la contribución de los efectos de polarización. Encontraron correlaciones lineales entre el calor parasítico y la cantidad de Li activo perdido, lo que permitió determinar el cambio de entalpía de las reacciones parasíticas, que para este caso se estimó en -212 kJ mol-1. Se descubrió que la energía parasítica era mayor con un electrodo de grafito de mayor área superficial en comparación con uno con menor superficie.
Downie et al 2013 combinaron un microcalorímetro TAM con un ciclador de batería para estudiar cualitativamente el efecto de un aditivo electrolítico en la estabilidad de LiCoO2/celdas de bolsa de grafito en un rango de voltaje definido. Se midieron ciclos de carga/descarga de baja corriente con diversas cantidades de carbonato de vinileno manteniendo las celdas idénticas en otros aspectos. Cualquier diferencia en el flujo de calor de las celdas que contienen el aditivo con respecto a un control sin aditivo podría atribuirse entonces al efecto del aditivo. Se observó un claro impacto en el flujo de calor: cuanto mayor era la concentración, menor era el flujo de calor, lo que indica una mayor estabilidad. Se concluyó además que, más allá de una determinada concentración (2%), el aditivo tenía sólo un efecto adicional menor sobre la estabilidad, lo que permitía evaluar la concentración óptima de carbonato de vinileno en el electrolito.
EVOLUCIONES ESTRUCTURALES
Durante la carga, los iones de Li se mueven desde el electrodo positivo y se intercalan en el electrodo negativo. Esto cambia la estructura del cristal, lo que afecta la entropía configuracional y puede detectarse en la señal del flujo de calor, el segundo término en la ecuación 1. Si se trata de un proceso reversible, la señal de carga/descarga se cancelará. Sin embargo, la entropía configuracional a veces proporciona una característica más fuerte en la señal del flujo de calor y esto puede correlacionarse con el revestimiento de litio, un evento que puede ser difícil de detectar mediante métodos electroquímicos. Downie, at al (2013).
Los datos del flujo de calor isotérmico también han revelado comportamientos materiales inesperados como la cristalización. Los eventos de cristalización dan lugar a una exotermia muy marcada que apenas se nota con métodos electroquímicos Chevrier et al (2021).
EVALUACIONES DE SEGURIDAD
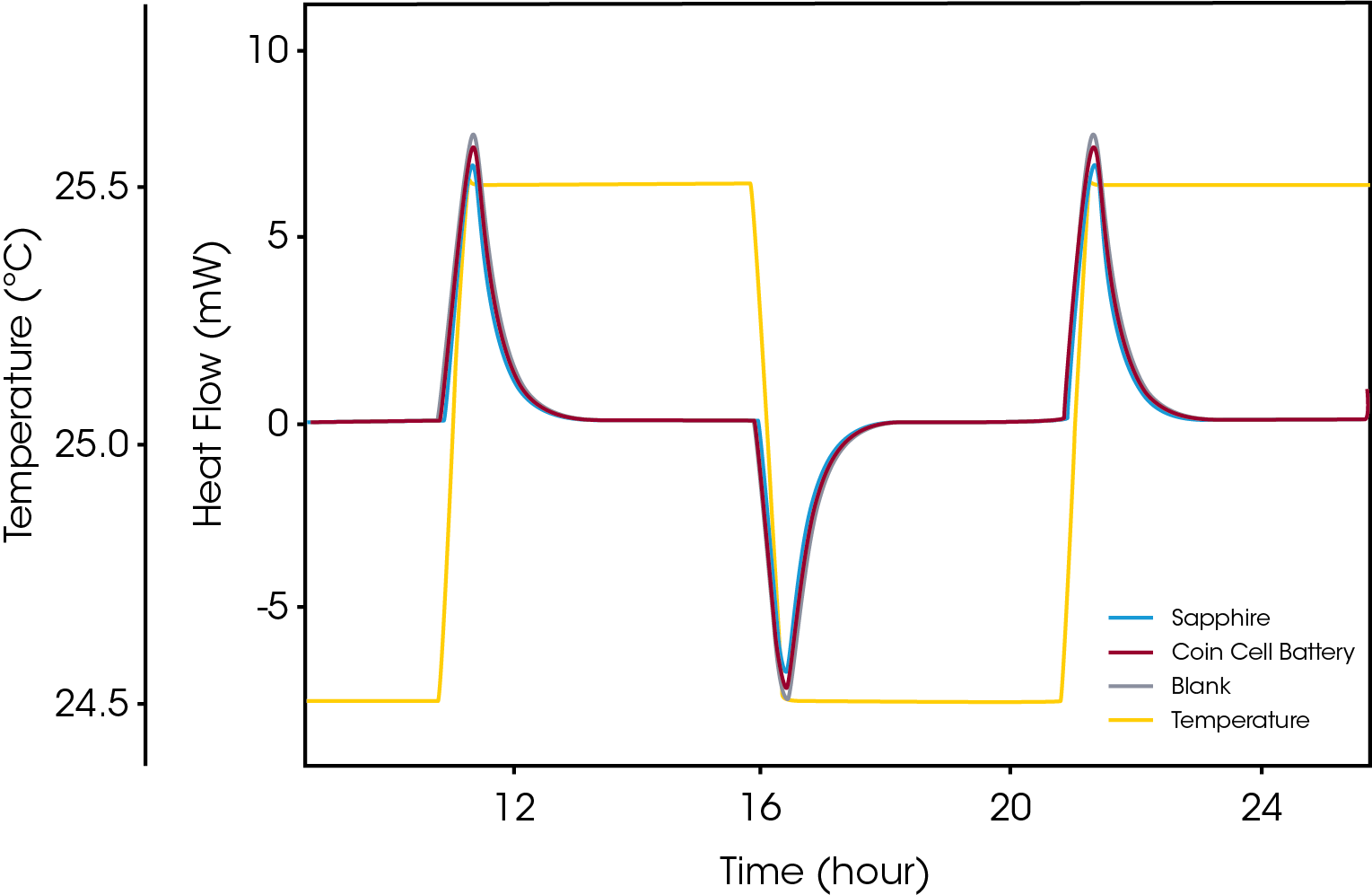
El almacenamiento de energía química a altas densidades generalmente va acompañado de riesgos para la seguridad debido a la posibilidad de descomposición exotérmica que puede provocar reacciones descontroladas que resulten en un incendio o una explosión. Al igual que ocurre con el almacenamiento de materiales de alta energía como los explosivos, esto se aplica a las baterías, donde, por ejemplo, se están haciendo esfuerzos para aumentar el contenido de energía de las celdas de iones de litio en las que el litio en su forma reducida es muy reactivo. La tasa de producción de calor en el material es naturalmente un parámetro crítico al evaluar posibles situaciones de temperatura descontrolada. La microcalorimetría es una técnica probada para evaluaciones que se aplican a una variedad de materiales de alta energía. Además de la tasa de producción de calor, la estimación del aumento de temperatura en una batería durante diversos estados de carga en situaciones de carga o recarga requiere una determinación confiable de las propiedades térmicas de baterías completas. La capacidad calorífica de la batería es una de esas propiedades que puede determinarse con precisión mediante microcalorimetría. La Figura 4 muestra una medición típica “isotérmica escalonada” de una batería completa.
CONCLUSIONES
Con el desarrollo de instrumentos microcalorimétricos altamente flexibles que tienen límites de detección cercanos a un nanovatio, se observa un mayor interés por las mediciones calorimétricas en la investigación, el desarrollo y el control de calidad de las baterías. Con la gama de recipientes de inserción de diferentes formas y tamaños, se pueden medir fácilmente baterías completas de diferentes formas, como monedas, cilindros de tamaños AA, AAA y 18650, y bolsas, ya sea en condiciones de circuito abierto o cerrado.
El límite de detección de los calorímetros TAM IV más sensibles permite mediciones de bajas tasas de autodescarga incluso en las baterías con forma de moneda más pequeñas o del flujo de calor de los ciclos de carga/descarga a corrientes muy bajas.
En combinación con una fuente de corriente y un voltímetro o un ciclador de baterías comercial, la determinación cuantitativa de reacciones parásitas se puede determinar fácilmente como una función del voltaje, la temperatura y la química variable de la batería.
La flexibilidad del sistema TAM permite diseñar multitud de configuraciones experimentales y los límites experimentales solo dependen de la imaginación o la creatividad del investigador.
REFERENCIAS
1. Chevrier et al (2021) Isothermal Calorimetry Evaluation of Metallurgical Silicon as a Negative Electrode Material for Li-Ion Batteries, J. Electrochem. Soc. 168
2. Downie (2013) The Impact of Electrolyte Additives Determined Using Isothermal Microcalorimetry, ECS Electrochemistry Letters, 2 (10)
3. Downie (2013) In Situ Detection of Lithium Plating on Graphite Electrodes by Electrochemical Calorimetry, Journal of The Electrochemical Society, 160 (4)
4. Hansen, L.D., and Hart (1978) The characterization of internal power losses in pacemaker batteries by calorimetry, J. Electrochem. Soc.: Electrochemical science and technology 125(6).
5. Krause, L. J., Jensen, L. D., and Dahn, J. R. (2012) Measurement of parasitic reactions in Li-ion cells by electrochemical calorimetry, J. Electrochem. Soc 159 (7).
6. Roth, E. P. (1999) Thermal Stability of Li-Ion Cells, United States. https://www.osti.gov/servlets/purl/14010.
7. Suurkuusk, J., Suurkuusk, M., and Vikegard, P. (2017) A multichannel microcalorimetric system: The third generation thermal activity monitor (TAM III), J. Therm. Anal. Calorim. 131.
RECONOCIMIENTO
Este artículo fue escrito por Peter Vikegard, Ph.D., soporte de aplicaciones en TA Instruments.
Para obtener más información o solicitar una cotización de producto, visite http://www.tainstruments.com/ para localizar la información de su oficina de ventas local.
Haga clic aquí para descargar la versión imprimible de esta nota de aplicación.

