Mots clés : microcalorimétrie, électrochimie, batteries lithium-ion, réactions parasites, durée de vie de la batterie
MC169-FR
Résumé
Le cyclage de batteries jusqu’à défaillance prend beaucoup trop de temps et retarde l’analyse des données, qui est essentielle pour le développement de nouvelles chimies de batterie. L’une des difficultés rencontrées consiste à déterminer l’activité des réactions parasites, qui peuvent impacter de manière significative les performances et la longévité des batteries lithium-ion. La calorimétrie électrochimique in situ est la principale technique d’étude de ces réactions parasites. La solution qui utilise un microcalorimètre couplé un cycleur de batteries (Battery Cycler Microcalorimeter Solution) associe la microcalorimétrie isotherme sensible à l’analyse électrochimique. Dans ce travail, elle est utilisée pour mesurer la puissance parasite d’une cellule Panasonic NCR18650GA. Les résultats peuvent fournir des informations qui permettent de prévoir le cycle et la durée de vie des cellules, juger de leur qualité, contribuer à la formulation des matériaux actifs, explorer l’impact des additifs et étudier la formation et la croissance de l’interphase de l’électrolyte solide.
Introduction
Le cycle de vie, l’efficacité et la qualité globale d’une batterie lithium-ion (BLI) sont largement déterminés par la réversibilité des réactions électrochimiques qui se produisent au cours de sa charge et de sa décharge [1]. Bien que la détermination du cycle de vie soit relativement simple d’un point de vue analytique, elle reste un goulot d’étranglement majeur dans le déroulement des tests [2]. Le cyclage d’une cellule jusqu’à sa défaillance est un processus qui peut prendre plusieurs mois et qui ralentit donc de manière significative le rythme des recherches et repousse l’obtention des informations critiques pour le contrôle qualité. Les tendances des recherches les plus récentes portent sur l’identification de caractéristiques diagnostiques pouvant être utilisées pour prévoir de manière exacte le comportement à long terme [2,3]. Un exemple frappant est l’étude des réactions parasites, qui ont été associées à une accélération de la diminution de la capacité, une réduction de l’efficacité coulombique et une défaillance précoce des cellules [1,2,4,5]. Une réaction parasite est un terme générique désignant toutes les réactions secondaires, chimiques ou électrochimiques qui se produisent à l’intérieur d’une batterie. Celles-ci peuvent comprendre la dégradation du solvant, le placage du lithium, la croissance de l’interphase de l’électrolyte solide (solid electrolyte interphase, SEI), la dégradation de la SEI et l’autodécharge [5].
L’évaluation de l’efficacité coulombique est une technique classique pour mesurer la quantité d’énergie perdue dans un cycle de batterie, les pertes étant supposées à l’origine des réactions parasites (Équation 1).
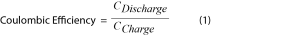
Si la détermination de l’efficacité coulombique peut être utile, elle ne rend compte que de la perte d’énergie due aux réactions secondaires électrochimiques. Compte tenu de la complexité et de la variété des réactions parasites dans une batterie lithium-ion, l’efficacité coulombique ne reflète pas la totalité des comportements des processus chimiques et électrochimiques [2,6]. Pour saisir la globalité de l’activité des réactions parasites dans des conditions de cyclage, une technique d’analyse secondaire doit être associée à l’électrochimie in situ. La principale stratégie qui répond à cette nécessité consiste à coupler la microcalorimétrie isotherme à haute résolution avec les techniques électrochimiques établies [1,2,4,5,7].
La calorimétrie électrochimique est un outil qui permet d’examiner l’activité du flux de chaleur d’une batterie au cours d’un cyclage actif. Bien qu’il s’agisse d’une technique puissante, la complexité et la mobilisation intensive des ressources des laboratoires ont réduit son intérêt pratique. Cette procédure nécessite généralement d’adapter le matériel aux exigences des expérimentations, de synchroniser les paramètres et les heures de début des expérimentations sur deux instruments dotés d’interfaces logicielles distinctes, de fusionner les fichiers de données et d’effectuer les calculs indispensables avant de voir le premier tracé. La solution qui utilise un microcalorimètre couplé à un cycleur de batteries de TA Instruments est conçue pour simplifier ce processus en intégrant le calorimètre et le potentiostat aux niveaux matériel et logiciel.
Le microcalorimètre couplé à un cycleur de batterie mesure en temps réel l’activité du flux de chaleur d’une batterie en utilisant différents formats de cellules standard, notamment des cellules boutons, 18650 et sachets. Les mesures peuvent être effectuées sur un intervalle de températures ambiantes et dans différentes conditions de cyclage. Les données provenant du calorimètre et du potentiostat sont horodatées pour corréler de manière exacte les événements thermiques et les stimuli électrochimiques. La contribution thermique des réactions parasites (puissance parasite) est isolée du signal du flux de chaleur total en utilisant une série de calculs réalisée automatiquement par TAM Assistant, le logiciel d’acquisition et d’analyse des données de TA Instruments. Dans cette présentation, la solution qui utilise un microcalorimètre couplé à un cycleur de batteries de TA Instruments est utilisée pour explorer l’efficacité et les réactions parasites de batteries sur une cellule Panasonic NCR18650GA.
Données expérimentales
La solution qui utilise un microcalorimètre couplé à un cycleur de batteries intègre un potentiostat de haute précision, le potentiostat BioLogic VSP-300, et le microcalorimètre isotherme TAM IV de TA Instruments. Le logiciel TAM Assistant contrôle à la fois le calorimètre et le potentiostat afin de corréler automatiquement les événements du flux de chaleur avec l’électrochimie dans des fichiers de résultats, comme le montre la Figure 1.
Les élévateurs précâblés du TAM IV établissent les contacts électriques entre le potentiostat et la batterie, tout en minimisant les bruits qui proviennent des fluctuations thermiques ambiantes dans la pièce. Les terminaux du sommet (+) et de la base (-) sont munis d’attaches à ressort qui établissent un contact ferme entre la batterie et l’élévateur, sans nécessiter de soudure ou d’isolement électrique complémentaire. La connexion à quatre fils est établie avec la batterie selon une configuration à deux électrodes, deux fils pour le courant et deux fils pour la détection de tension
(+/-). Les quatre fils conduisent un connecteur claveté, sur lequel un câble (ajusté en longueur) établira l’interface avec les électrodes du potentiostat. La Figure 2 montre en détail les différents composants dans l’élévateur du macrocalorimètre pour des cellules de batterie 18650.


Étalonnage
Le système est étalonné en utilisant le dispositif de chauffage d’étalonnage externe en forme de batterie (encadré de la Figure 3), disponible pour chaque type d’élévateur. Ces dispositifs de chauffage d’étalonnage reproduisent les dimensions physiques d’une cellule réelle et contiennent une résistance de haute précision de 1 000 Ω afin d’émettre une quantité de chaleur connue. Le logiciel TAM Assistant contient un certain nombre d’assistants d’expérimentation, notamment un assistant d’étalonnage qui guide l’utilisateur à travers la méthode.
Pour commencer l’étalonnage, installer le dispositif de chauffage d’étalonnage dans l’élévateur et le charger dans le calorimètre en utilisant la procédure opérationnelle standard qui se trouve dans le Guide de démarrage du microcalorimètre couplé à un cycleur de batteries. Laisser le dispositif de chauffage d’étalonnage atteindre l’équilibre thermique avec la température du bain, et laisser la base se stabiliser. À l’invite, le potentiostat appliquera une impulsion de courant, conduisant la batterie d’étalonnage à émettre une quantité connue de chaleur. La Figure 3 montre le fichier de résultats pour l’étalonnage du gain, établissant la courbe des signaux de tension et de flux de chaleur par rapport au temps.
Cette méthode d’étalonnage permet d’obtenir des valeurs à la fois pour le gain et pour la compensation. Des étalonnages sont effectués en usine en fonction de la température sur chaque calorimètre vide de TA Instruments avant l’expédition. Tout changement de la configuration du calorimètre, y compris l’insertion d’un élévateur, entraîne une déviation par rapport à la valeur étalonnée. Le facteur de gain corrige ces différences, produisant une constante de gain spécifique à la configuration de l’utilisateur. La compensation est la déviation du signal initial par rapport au zéro, qui est automatiquement ajustée après l’étalonnage.
Détermination de la chaleur parasite sur une batterie lithium-ion 18650
Le bain du TAM IV a été réglé à 40 °C et pour une période de stabilisation de 24 heures. Une batterie lithium-ion Panasonic NCR18650GA de 3 400 mAh a été chargée dans l’élévateur de batterie et insérée dans le calorimètre selon la méthode standard. La batterie a été précyclée entre 3,0 et 4,2 V à 250 mA, pour un total de 10 cycles afin de conditionner la batterie à la température du test (10 à 20 cycles sont recommandés). Il s’ensuit une période de repos de 24 heures afin d’atteindre un équilibre thermique et de stabiliser la chimie de la batterie. Pour obtenir de meilleurs résultats, la mesure de la chaleur parasite doit être réalisée à des taux de cycles de charge lents (« C-rates »). Cette cellule a été réglée sur un cycle de 172 mA (C/20), pendant cinq cycles entre 3,0 et 4,2 V, avec une période de repos d’une heure entre chaque phase de charge et de décharge. L’assistant du cycleur de batterie dans TAM Assistant a été utilisé pour programmer et exécuter l’expérimentation.
Contexte théorique
Le signal du flux de chaleur pendant le cyclage de la batterie est décrit par l’équation 2 [1,5,7]
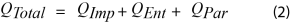
Où :
- QTotalest le flux de chaleur total
- QParest la puissance parasite
- QImpest la puissance d’impédance
- QEnt est la puissance entropique
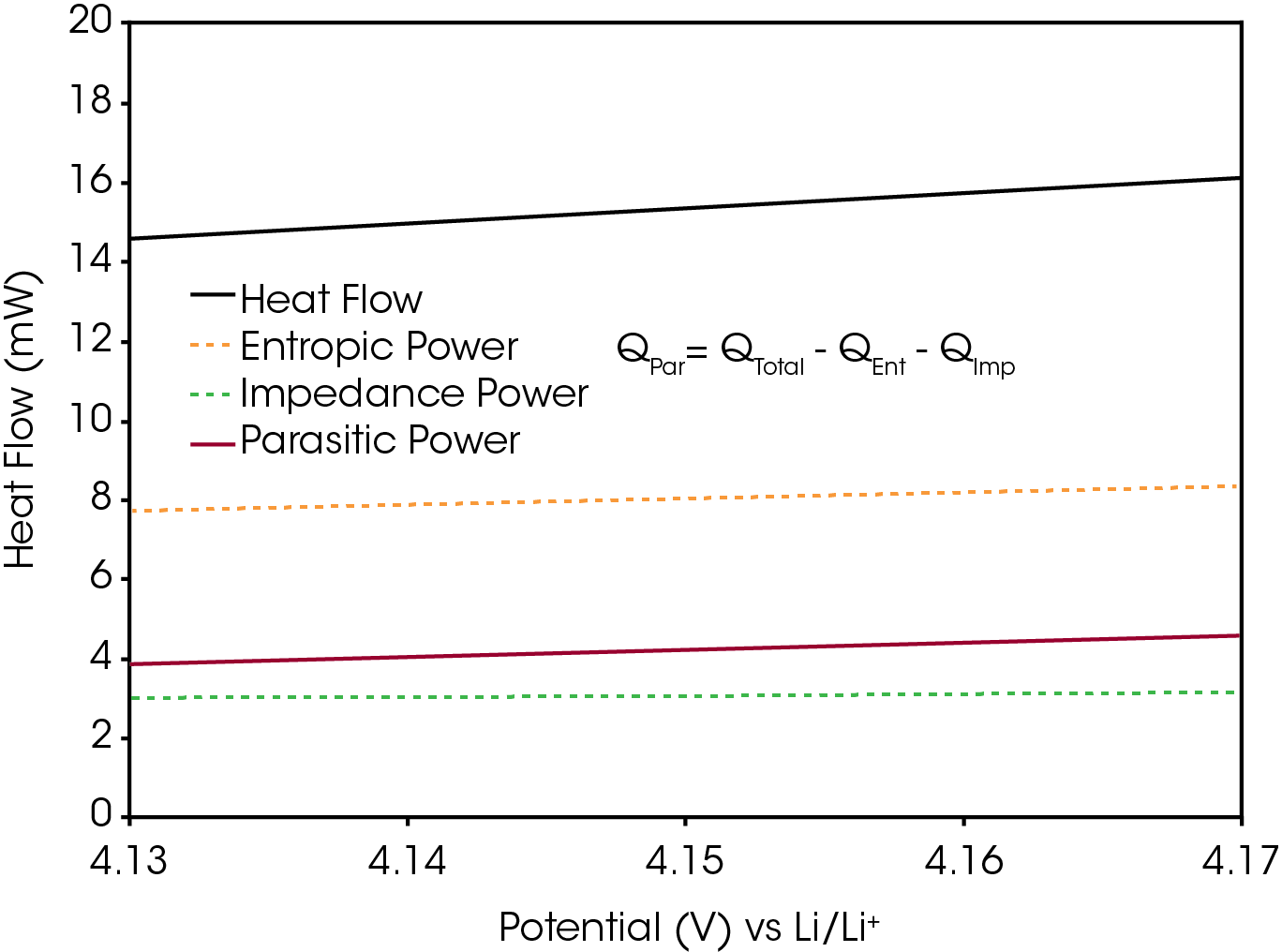
Le principal signal d’intérêt est QPar, c’est-à-dire la puissance parasite. Elle représente la somme de l’énergie thermique produite par des réactions secondaires non réversibles dans une batterie. Pour isoler ce signal du flux de chaleur total, il est nécessaire de soustraire la puissance d’impédance (QImp) et la puissance entropique (QEnt). La puissance entropique décrit le flux de chaleur associé à des changements réversibles de l’entropie. Elle constitue généralement la contribution la plus importante au flux de chaleur total pendant une opération de charge ou de décharge, comme le montre la Figure 4. La puissance entropique est principalement provoquée par l’intercalation et la désintercalation du lithium, et les changements structuraux correspondants des matériaux inactifs, notamment l’expansion de la couche de graphite. Ces processus sont réversibles, c’est-à-dire que leurs flux de chaleurs associés sont également réversibles. Par conséquent, la puissance entropique pendant la charge doit être d’amplitude égale, mais de signe opposé, à la puissance entropique pendant la décharge [5]. L’équation 3 décrit la somme des flux de chaleurs totaux intégrés pendant un cycle complet en soustrayant la contribution de QEnt de QTotal, ne conservant que QPar et QImp.
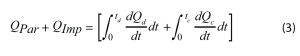
Où Q est le signal du flux de chaleur,test le temps et les indices d ou c indiquent respectivement une opération de décharge et de charge.
La puissance d’impédance est la chaleur perdue générée par le passage du courant à travers un matériau résistant, également dénommée effet Joule. Elle est calculée à partir des données électrochimiques en utilisant l’équation 4.
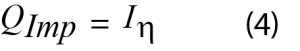
Où I est le courant appliqué et η est la surtension.
La surtension dans cette équation représente la différence entre la tension en circuit ouvert et la tension sous charge. Le courant appliqué sera constant, mais la surtension pourra varier en fonction de l’état de charge. Elle peut être mesurée directement en appliquant une impulsion en circuit ouvert à intervalles périodiques, ou en établissant la courbe de la tension par rapport à la capacité, et en mesurant l’hystérésis des courbes de charge et de décharge. Pendant un cycle complet, la puissance d’impédance moyenne peut être calculée en utilisant l’équation 5.
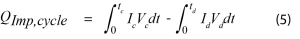
Où I est le courant appliqué et V est la tension pendant une opération de charge ou de décharge.
Ce signal est toujours exothermique, mais sa contribution peut être minimisée en utilisant des taux de courants lents. Lorsque les valeurs moyennes de la puissance d’impédance et de la puissance entropique sont déterminées, l’équation 6 peut être utilisée pour déterminer la puissance parasite moyenne par cycle.
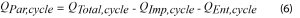
Où, par définition, QEnt,cycle sera égale à zéro.
Résultats et discussions
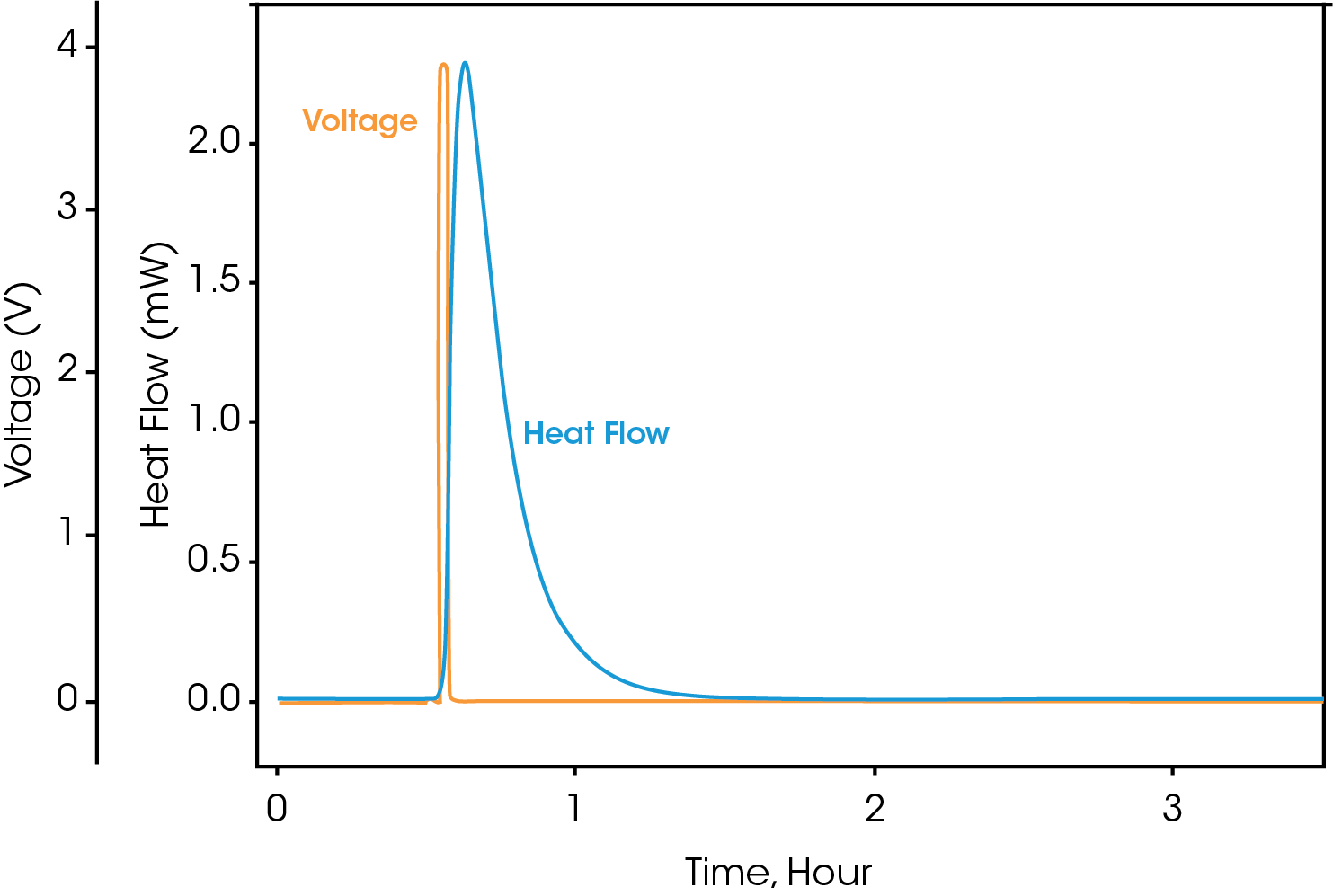
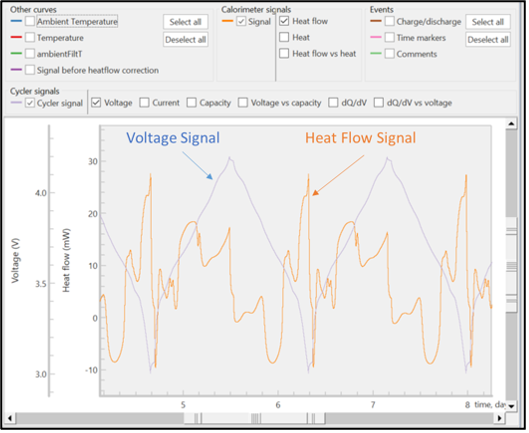
Les signaux non traités du flux de chaleur et de la tension sont présentés sur la Figure 5. Tous les signaux bruts sont horodatés de telle sorte que les données électrochimiques et colorimétriques peuvent être corrélées de manière exacte. Les signaux bruts de tension, de courant et de flux de chaleur peuvent être observés pendant une expérimentation active, mais les valeurs calculées ne peuvent être obtenues que lorsque l’expérimentation est terminée.
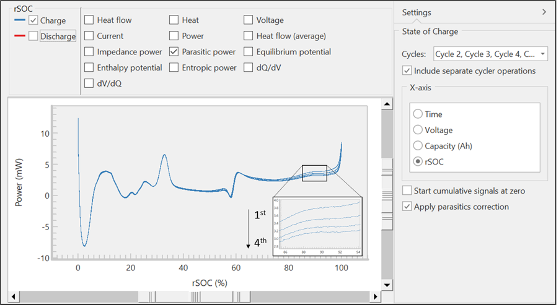
À partir de ces signaux bruts, le logiciel TAM Assistant calculera automatiquement les valeurs principales et les présentera sous forme de tableau ou de courbe. La Figure 6 montre la fenêtre de la courbe, avec plusieurs options pour l’axe des abscisses (x) sur la droite, et de nombreuses options pour l’axe des ordonnées (y) vers le sommet de la fenêtre. Le logiciel offre la possibilité de superposer les différents signaux calculés et bruts, de superposer différents cycles, et de séparer la charge de la décharge. Ces outils ont été conçus pour maximiser la flexibilité, la rapidité et la facilité d’utilisation, de telle sorte que les opérateurs puissent découvrir plus efficacement les principales tendances ou caractéristiques au sein des données.
Les données présentées sur la Figure 6 montrent la puissance parasite de la branche de charge pendant quatre cycles par rapport à l’état de charge relatif (relative state of charge, rSOC). Les pics observés aux limites supérieure et inférieure du rSOC sont des artefacts, qui résultent de l’asymétrie inhérente à proximité des marges des courbes de la tension et du flux de chaleur. Ils sont désignés par le terme d’effets de bord [5]. Une inspection plus précise des courbes superposées montrera que la puissance parasite diminue lors de chaque cycle, correspondant au comportement classique de la formation d’une couche de passivation, comme l’interphase de l’électrolyte solide (solid electrolyte interphase, SEI) [8].
Nous pouvons également observer des tendances dans ces données sur de multiples cycles. La Figure 7 montre la puissance parasite moyenne et l’efficacité coulombique sur quatre cycles. Au fur et à mesure que la puissance parasite diminue, l’efficacité coulombique augmente, conformément à des études précédentes [5]. Cela correspond aux attentes théoriques, dans la mesure où il s’agit de la mesure du même événement à partir de côtés opposés. L’efficacité coulombique est une mesure de l’efficacité électrochimique ; à l’inverse, la puissance parasitaire est une mesure de l’inefficacité, qui comprend les réactions secondaires chimiques et électrochimiques. Une bonne pratique consiste à suivre l’efficacité coulombique, car elle peut être utilisée pour valider les données thermiques, comme cela est effectué sur la Figure 7.

Conclusions
La quantification de l’activité parasite est essentielle pour juger de l’efficacité et de la qualité et pour comprendre la chimie sous-jacente des batteries lithium-ion. Une solution qui utilise un microcalorimètre couplé à un cycleur de batteries de TA Instruments a été utilisée pour explorer la puissance parasite sur une cellule Panasonic NCR18650GA. Le logiciel TAM Assistant facilite l’intégration et le contrôle du thermostat, des calorimètres et du potentiostat, améliorant ainsi l’utilité pratique et l’utilisabilité de la calorimétrie sur les batteries. Sur de multiples cycles, différentes tendances, telles que l’augmentation de l’efficacité coulombique avec une diminution de la puissance parasite, peuvent être mesurées. Ces données peuvent aider les chercheurs à trouver les formulations de nouveaux matériaux actifs, en montrant l’impact des additifs sur la réduction de l’activité parasite, en étudiant la SEI ou en examinant des cellules qui présentent une activité parasite supérieure à la normale au cours d’un contrôle qualité.
Références
-
- L.J. Krouse, L.D. Jensen, J.R. Dahn. Measurement of Parasitic Reactions in Li Ion Cells by Electrochemical Calorimetry. J. Electrochem. Soc. 2012, 159 (7), A937-A943.
pdf (iop.org) - J.C. Burns, Adil Kassam, N.N. Sinha, L.E. Downie, Lucie Solnickova, B.M. Way, J.R. Dahn. Predicting and Extending the Lifetime of Li-Ion Batteries. J. Electrochem. Soc. 2013, 160, A1451.
Predicting and Extending the Lifetime of Li-Ion Batteries – IOPscience - Wei Xiong, Gang Xu, Yumei Li, Feng Zhang, Pang Ye, Ben Li. Early prediction of lithium-ion battery cycle life based on voltage-capacity discharge curves. Journal of Energy Storage, 2023, 62, 106790. Early prediction of lithium-ion battery cycle life based on voltage-capacity discharge curves – ScienceDirect
- L.E. Downie, S.R. Hyatt, J.R. Dahn. The Impact of Electrolyte Composition on Parasitic Reactions in Lithium Ion Cells Charged to 4.7 V Determined Using Isothermal Microcalorimetry. J. Electrochem. Soc. 2016, 163 (2), A35-A42.pdf (iop.org)
- L.J. Krouse, L.D. Jensen, V.L. Chevrier. Measurement of Li-Ion Battery Electrolyte Stability by Electrochemical Calorimetry. J. Electrochem. Soc. 2017, 164 (4), A889-A896.Measurement of Li-Ion Battery Electrolyte Stability by Electrochemical Calorimetry – IOPscience
- Seong Jin An, Jianlin Li, Claus Daniel, Debasish Mohanty, Shrikant Nagpure, David L. Wood. The state of understanding of the lithium-ion-battery graphite solid electrolyte interphase (SEI) and its relationship to formation cycling. Carbon, 2016, 105, 52-76.
- Alexander Kunz, Clara Berg, Franzika Friedrich, Hubert A. Gasteiger, Andreas Jossen. Time-Resolved Electrochemical Heat Flow Calorimetry for the Analysis of Highly Dynamic Processes in Lithium-Ion Batteries. J. Electrochem. Soc. 2022, 169, 080513.Time-Resolved Electrochemical Heat Flow Calorimetry for the Analysis of Highly Dynamic Processes in Lithium-Ion Batteries – IOPscience
- Luchkin, S.Y., Lipovskikh, S.A., Katorova, N.S., Savina, A.A., Abakumov, A.M, Stevenson, K.J. Solid-electrolyte interphase nucleation and growth on carbonaceous negative electrodes for Li-ion batteries visualized with in situatomic force microscopy. Sci Rep,2020, 10, 8550. https://doi.org/10.1038/s41598-020-65552-6
- L.J. Krouse, L.D. Jensen, J.R. Dahn. Measurement of Parasitic Reactions in Li Ion Cells by Electrochemical Calorimetry. J. Electrochem. Soc. 2012, 159 (7), A937-A943.
Remerciements
Cet article a été rédigé par Jeremy May, PhD de TA Instruments
Cliquez ici pour télécharger la version imprimable de cette note d’application.

