Mots clés : DSC, DSCM, batterie lithium-ion, électrolyte, basses températures
TA468-TW
Résumé
Les électrolytes dans les batteries lithium-ion sont nécessaires pour maintenir l’état liquide pour un transport ionique optimal et de bonnes performances de la batterie. La compréhension de la transition de phases des électrolytes est essentielle pour améliorer les performances des batteries à basses températures, en particulier dans les climats plus froids. La calorimétrie différentielle à balayage (DSC) fournit une mesure simple qui permet d’évaluer la cristallisation et la fusion des électrolytes. Des électrolytes à haute concentration peuvent être surfondus et rester liquides après un rapide refroidissement, entraînant une cristallisation lors du chauffage. La cristallisation et la fusion à froid qui en résultent peuvent se superposer dans le même intervalle de températures, ce qu’une expérimentation traditionnelle en DSC n’est pas en mesure d’analyser pleinement. La DSC modulée sépare la cristallisation en un signal de flux de chaleur non inversé et la fusion dans un signal de flux de chaleur inversé. Cela permet une intégration claire et précise de l’enthalpie liée à la cristallisation et à la fusion de manière individuelle, et permet donc une meilleure compréhension du mécanisme de transition de phases sur un intervalle de températures. Deux électrolytes disponibles dans le commerce sont évalués dans ce travail afin de comprendre les transitions à basses températures qui peuvent avoir un impact sur les performances des batteries.
Introduction
Les électrolytes dans les batteries lithium-ion (LIB) permettent aux ions de se déplacer entre l’anode et la cathode afin de charger et de décharger la batterie. Une difficulté importante est d’obtenir une densité énergétique élevée tout en maintenant la stabilité et la longévité dans un certain nombre de conditions de fonctionnement. La formulation électronique contient un sel, le plus souvent LiPF6, dans une solution aqueuse ou organique [1]. Le carbonate d’éthylène (CE), le carbonate d’éthyle méthyle (CEN) et le carbonate de diméthyle (CDM) sont souvent utilisés, mais peuvent être limités à des tensions plus élevées à cause de l’oxydation. L’ajout d’additifs à la formule permet l’utilisation à des tensions élevées, mais limite également la concentration de CE, ce qui est bénéfique pour un fonctionnement à basse température [2] [3].
L’un des reproches fréquents adressés aux LIB est une diminution d’efficacité à des températures froides. Si l’électrolyte gèle, le transport ionique est réduit, et les performances de la batterie en sont impactées. L’analyse des électrolytes afin d’identifier les transitions de phases à basses températures fournit un outil de formulation utile et contribue à prévoir les performances des batteries dans les conditions de fonctionnement. La calorimétrie différentielle à balayage (DSC) fournit une méthode simple pour mesurer les changements de flux de chaleur pendant la transition de phases d’un matériau. L’appareil Discovery DSC de TA Instruments peut être utilisé pour effectuer des tests en DSC traditionnelle et en DSC modulée (DSCM) afin de comprendre la transition de phase des électrolytes, notamment cristallisation, température de fusion et enthalpie des phases de transition.
La DSC traditionnelle mesure les flux de chaleur en fonction d’une rampe de températures linéaire dans un échantillon ; la DSCM ajoute à la DSC traditionnelle l’application d’une modulation sinusoïdale à une température de chauffage moyenne [4] [5]. Le signal inversé de la DSC est la réponse en flux de chaleur au taux de chauffage et mesure la capacité calorifique (Cc), les changements de la capacité calorifique et la fusion cristalline. Le signal non inversé mesure la réponse en flux de chaleur à une température absolue et à la durée, enregistrant les processus cinétiques tels que cristallisation, décomposition, évaporation, relaxation moléculaire et réactions chimiques. La capacité de résoudre des transitions complexes en composants spécifiques à partir des mesures de DSCM améliore l’interprétation des données. Dans cette note, un calorimètre différentiel à balayage (DSC) de TA Instruments est utilisé pour effectuer les mesures en DSC traditionnelle et en DSCM des électrolytes de LIB afin de comprendre la transition des phases en fonction de la température.
Données expérimentales
Deux types d’électrolytes commerciaux ont été fournis par SpectraPower (Livermore, Californie), et ont été désignés comme Électrolyte A et Électrolyte B dans cette étude. Un DSC de TA Instruments DSC doté de la technologie Tzero a mesuré le signal du flux de chaleur pendant le chauffage et le refroidissement des échantillons d’électrolytes. Des échantillons d’environ 10 mg ont été préparés à l’intérieur d’un sac à gants et scellés dans un récipient hermétique Tzero. Les échantillons ont été d’abord refroidis à -120 °C, puis progressivement réchauffés à raison de 10 °C/min de -120 °C à 40 °C afin d’évaluer la congélation et la fusion des électrolytes. La survenue et le pic des températures de cristallisation et de fusion ont été mesurés, ainsi que l’enthalpie de la transition de phases.
Une MDSC a été effectuée en utilisant la méthode de chauffage modulé uniquement, présentée dans le Tableau 1 avec une période de modulation de 60 secondes et une rampe de chauffage de 2 °C/min de -120 °C à 40 °C.
Tableau 1. Procédure de MDSC en chauffage modulé uniquement
| Test | Chauffage modulé uniquement |
|---|---|
| Période de modulation | 60 sec |
| Taux de rampe | 2 °C/min |
| Température initiale | -120 °C |
| Température finale | 40 °C |
Résultats et discussions
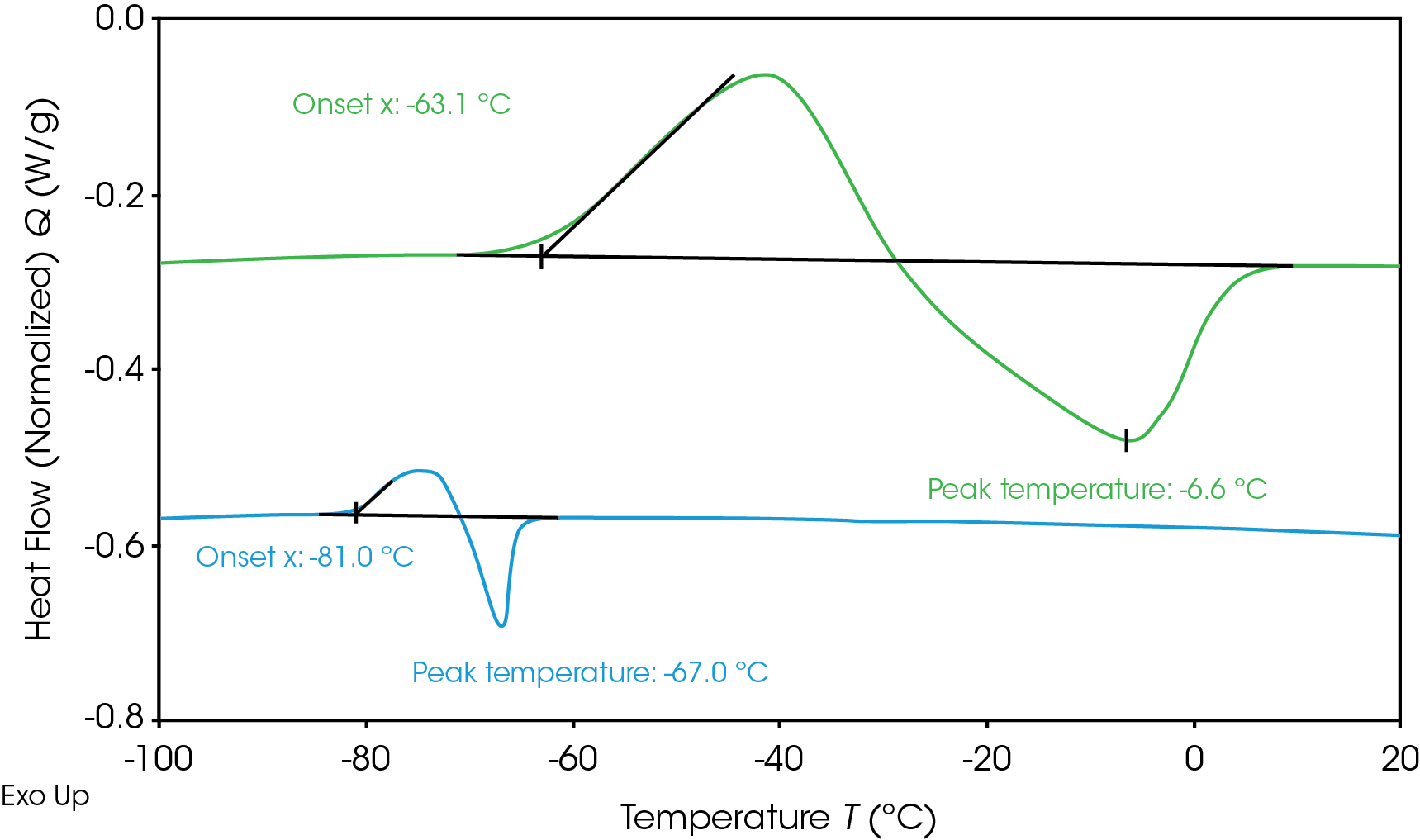
Déterminer les transitions de phase des électrolytes contribue à prévenir une congélation pendant le fonctionnement de la batterie à des températures froides. Le flux de chaleur des électrolytes au cours de la congélation et de la décongélation mesuré par DSC est présenté sur la Figure 1. Les électrolytes ont été refroidis à -120 °C, puis chauffés afin de mesurer les transitions de phase. Aucun des électrolytes n’a montré de cristallisation pendant le refroidissement, ce qui a entraîné une solution surfondue ; cependant, les deux ont cristallisé à la chaleur (cristallisation froide) [6]. L’Électrolyte A (vert) montre un début de cristallisation à
-63,1 °C, et un pic de fusion à -6,6 °C. L’Électrolyte B (bleu) montre un début de cristallisation inférieur à -81 °C et un pic de fusion à -67 °C. Une température de fusion inférieure est souhaitable pour le fonctionnement à des températures plus froides, car l’électrolyte reste liquide sur un intervalle de températures plus large. Lorsque l’électrolyte gèle et cristallise, la mobilité des ions lithium est limitée, ce qui a un impact sur les performances de la batterie. Des ajustements peuvent être apportés à la formulation des électrolytes pour influencer la transition de congélation ou le système de gestion thermique afin d’empêcher la batterie d’atteindre la température de déclenchement de la congélation.
Le chevauchement des transitions présenté par l’Électrolyte A au cours de la congélation et de la fusion peut être mieux compris avec la MDSC. Au cours de la MDSC en chauffage uniquement, la température modulée ne diminue jamais et l’échantillon n’est jamais refroidi afin d’empêcher l’induction d’un impact du refroidissement sur la cristallisation [7]. La MDSC a séparé le chevauchement de la transition de cristallisation et de fusion (Figure 1) afin de distinguer les signaux de flux de chaleur non inversé pour la cristallisation et inversé pour la fusion (Figure 2). La séparation permet d’intégrer clairement l’enthalpie liée à la cristallisation et à la fusion de manière individuelle. L’enthalpie de cristallisation résultante de l’Électrolyte A est de 28,8 J/g et l’enthalpie de fusion de 28,8 J/g, ce qui indique que l’intégralité de la cristallinité a été formée au cours de la cristallisation froide lors du chauffage. Le taux de chauffage lent de 2 °C/min utilisé au cours de la MDSC, par rapport au taux de 10 °C/min de la DSC, améliore également la résolution et révèle un pic de cristallisation supplémentaire à -63,7 °C et -52,7 °C. La fusion survient immédiatement après la principale cristallisation et montre un pic à -5,6 °C.
L’Électrolyte B, présenté sur la Figure 3, montre deux pics séparés de cristallisation et de fusion. Comme l’Électrolyte A, l’enthalpie totale de cristallisation similaire (21,3 J/g) et l’enthalpie de fusion totale (21,3 J/gr) de l’Électrolyte B indique que tout le matériel cristallin s’est formé pendant la cristallisation froide lors du chauffage. Les enthalpies totales peuvent être séparées en deux pour une évaluation plus approfondie du mécanisme de cristallisation et de fusion de l’Électrolyte B.
Le logiciel TRIOS peut analyser l’intégration par la fonction « divide peak » (diviser les pics) pour montrer chaque enthalpie régionale et le pourcentage local, révélant à quel niveau l’enthalpie individuelle est survenue au cours de chaque événement de cristallisation et de fusion. Comme le montre le Tableau 2, même si les enthalpies totales de la fusion et de la cristallisation sont identiques, l’enthalpie pour la première cristallisation (14,9 J/g) et la fusion consécutive (12,8 J/g) n’est pas équivalente. La cristallisation consécutive (6,5 J/g) se produit et suit une fusion finale (8,5 J/g). Cela indique une cristallisation et une fusion hétérogènes des matériaux. Au cours de l’intervalle de températures du processus, il apparaît différentes phases à une température donnée, et cette analyse fournit des informations sur le mécanisme de transition de phase.
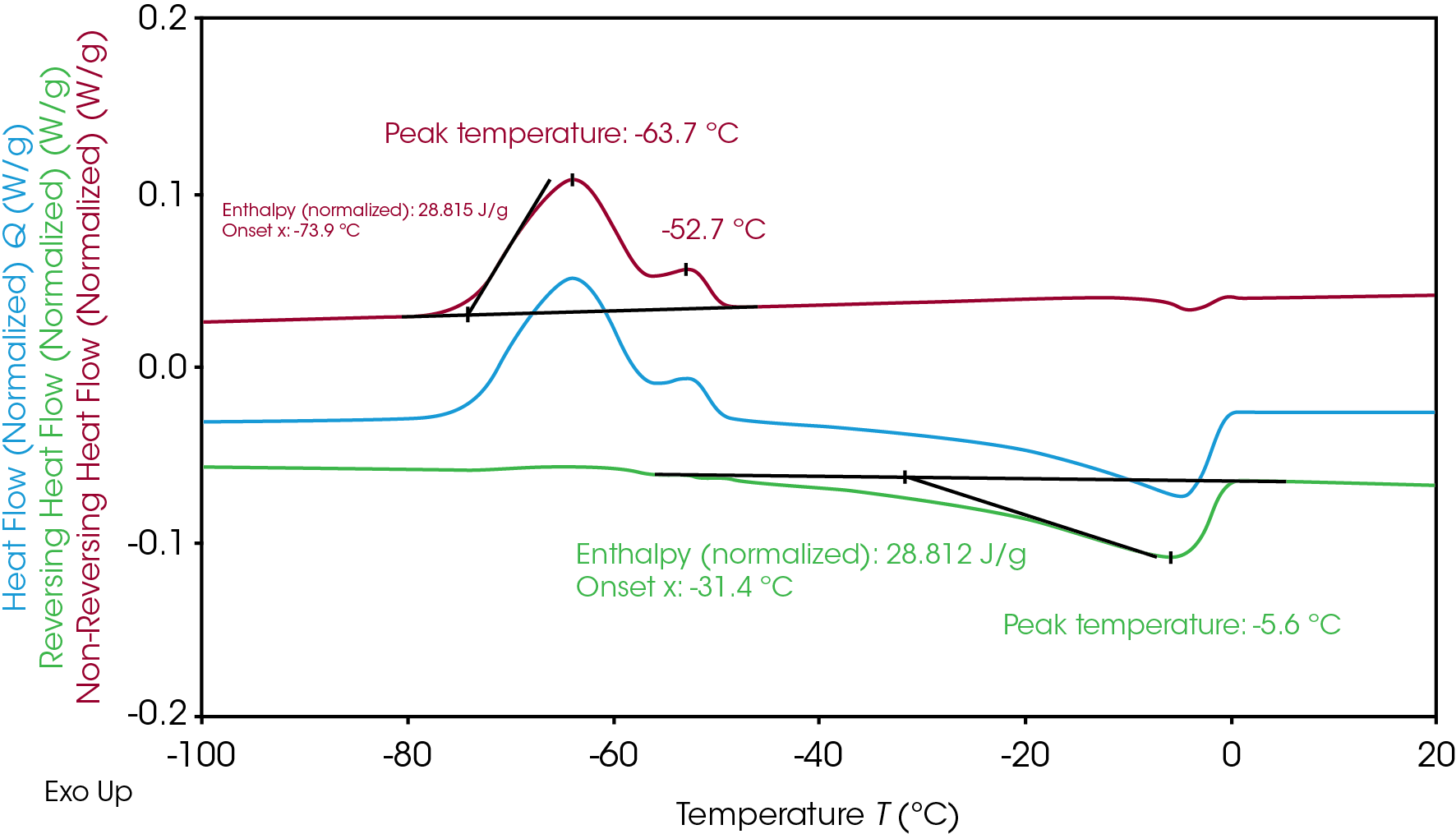
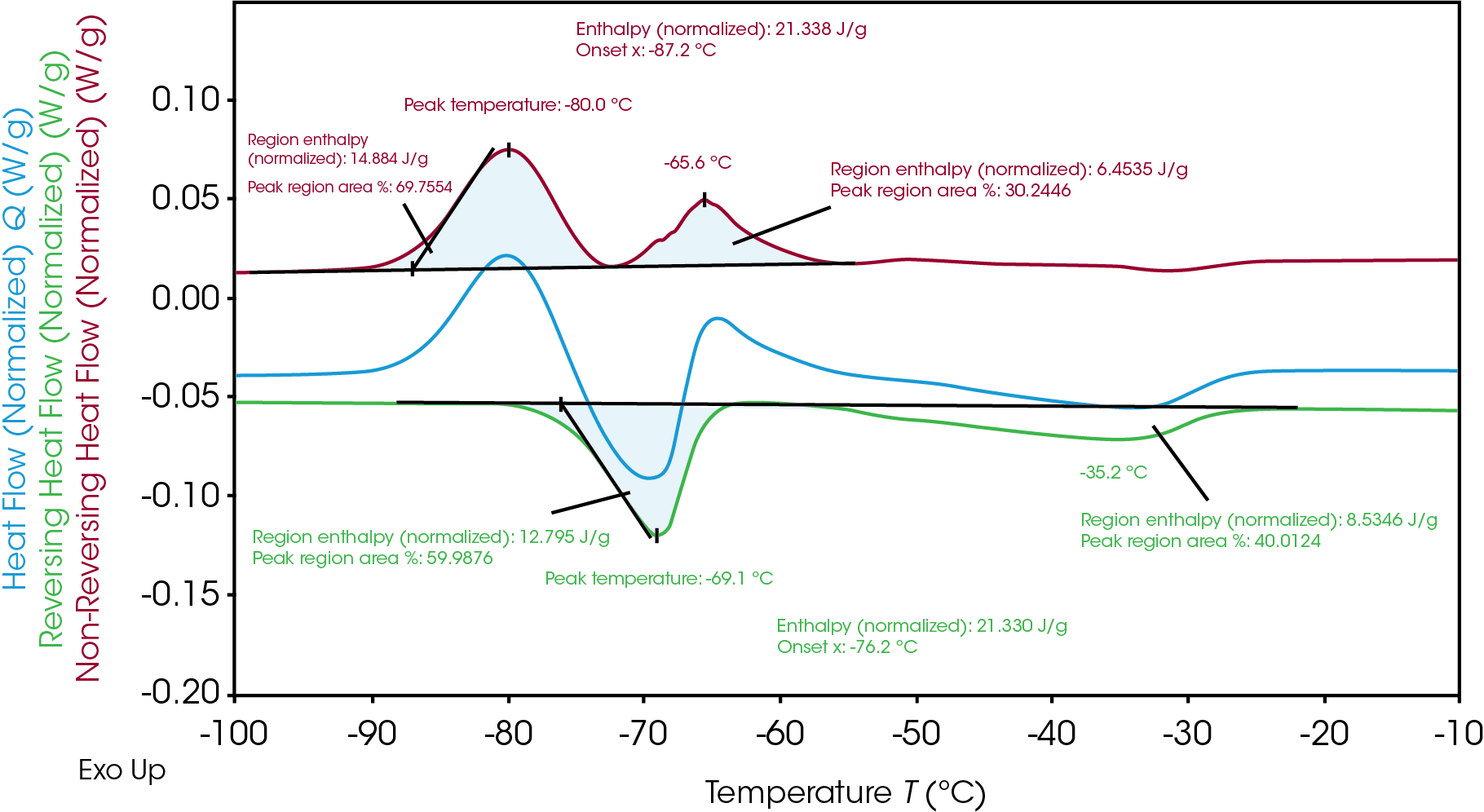
Tableau 2. Analyse des enthalpies de cristallisation et de fusion de l’Électrolyte B
| Température maximale (°C) | Enthalpie (J/g) | Signal du flux de chaleur | |
|---|---|---|---|
| 1re cristallisation | -80.0 | 14.9 | Non inversé |
| 1re fusion | -69.1 | 12.8 | Inversé |
| 2e cristallisation | -65.6 | 6.5 | Non inversé |
| 2e fusion | -35.2 | 8.5 | Inversé |
Conclusions
Comprendre les transitions de phase des électrolytes est essentiel pour les performances des batteries lithium-ion à basses températures. La calorimétrie différentielle à balayage mesure le flux de chaleur des électrolytes, et peut être utilisée pour déterminer l’apparition des températures de congélation et de fusion. La MDSC présente l’avantage de séparer les transitions de cristallisation et de fusion qui surviennent parfois dans le même intervalle de températures. Grâce à cette technique, les chercheurs peuvent explorer de nouvelles formulations pour améliorer les performances des batteries à basses températures et les fabricants peuvent utiliser une DSC pour le contrôle qualité des électrolytes.
Références
-
- H. Yang, G. V. Zhuang and P. N. Ross Jr., “Thermal Stability of LiPF6 salt and Li-ion battery electrolytes containing LiPF6,” Journal of Power Sources, vol. 161, pp. 573-579, 2006.
- E. R. Logan, E. M. Tonita, K. L. Gering, L. Ma, M. K. G. Bauer, J. Li, L. Y. Beaulieu and J. R. Dahn, “A Study of the Transport Properties of Ethylene Carbonate-Free Li Electrolytes,” Journal of the Electrochemical Society, vol. 165, no. 3, 2018.
- O. Lavi, S. Luski, N. Shpigel, C. Menachem, Z. Pomerantz, Y. Elias and D. Aurbach, “Electrolyte Solutions for Rechargeable Li-Ion Batteries based on FLuorinated Solvents,” ACS Applied Energy Materials, vol. 3, pp. 7845-7499, 2020.
- L. C. Thomas, “TP006 Modulated DSC® Paper #1: Why Modulated DSC®? ; An Overview and Summary of Advantages and Disadvantages Relative to Traditional DSC,” TA Instruments, New Castle, DE.
- TA Instruments, “TN34 Thermal Applications Note: Modulated DSCTM: A Simple Technique With Significant Benefits,” TA Instruments, New Castle, DE.
- L. A. Robertson, Z. Li, Y. Cao, I. A. Shkrob, M. Tyagi, K. C. Smith, L. Zhang, J. S. Moore and Y. Z, “Observation of Microheterogeneity in Highly Concentrated Nonaqueous Electrolyte Solutions,” Journal of the American Chemical Society, vol. 141, no. 20, pp. 8041-8046, 2019.
- TA Instruments, “TN045: Choosing Conditions in Modulated DSC®,” TA Instruments, New Castle, DE.
Remerciements
Cette note a été rédigée par Jennifer Vail, Ph. D. et Hang Lau, Ph. D. de TA Instruments.
Cliquez ici pour télécharger la version imprimable de cette note d’application.

