Mots clés: Calorimétrie différentielle à balayage, Dépistage de la stabilité thermique à haut débit, Stabilité thermique à court terme
MC177-FR
Résumé
Les essais de stabilité thermique des produits biothérapeutiques sont essentiels pour garantir la qualité des produits et obtenir l’approbation des autorités réglementaires pour les médicaments biologiques. Le RS-DSC (Calorimètre à balayage différentiel pour le dépistage rapide) de TA Instruments permet d’analyser jusqu’à 24 échantillons simultanément. En outre, de fortes concentrations de candidats médicaments protéiques peuvent être évaluées à l’aide de puces microfluidiques jetables de faible volume. Cette note d’application fournit des données qui illustrent l’utilité du RS-DSC de TA Instruments en évaluant la limite de détection et en démontrant la gamme de concentrations qui peuvent faire l’objet d’une analyse par calorimétrie à balayage différentiel (DSC).
Introduction
Les essais de stabilité thermique à court terme sont essentiels pour évaluer la résistance d’un composé au stress thermique, ce qui est essentiel pour prévoir la durée de conservation et maintenir l’efficacité. La calorimétrie à balayage différentiel (DSC) est une technique utilisée pour comprendre la structure des anticorps ; cependant, les échantillons de concentration de formulation sont difficiles à caractériser avec les instruments traditionnels. Ces difficultés sont dues à l’utilisation d’une cellule d’échantillon irremplaçable, qui nécessite de longues étapes de nettoyage pour éviter la contamination croisée de l’échantillon entre les balayages. La cellule d’échantillon fixe limite également la plage de concentration supérieure, car les protéines très concentrées sont plus susceptibles d’obstruer la cellule lors du chauffage. Dans le meilleur des cas, une cellule obstruée nécessite un nettoyage intensif et rigoureux pour être régénérée. Dans le pire des cas, une cellule peut être contaminée de manière irréversible. Les échantillons doivent donc être dilués par rapport à leur concentration dans la formulation. La concentration peut affecter la stabilité thermique des protéines. Une compréhension précise de la stabilité des protéines pour des médicaments potentiels dans des conditions de stockage nécessite donc de tester des échantillons de concentration de formulation.
Le RS-DSC de TA Instruments est une avancée innovante dans la technologie microcalorimétrique différentielle à balayage. Contrairement à d’autres DSC, le RS-DSC de TA Instruments ne nécessite pas la dilution des échantillons, car il est conçu de manière unique pour traiter des formulations de médicaments biologiques à haute concentration dans des puces microfluidiques jetables et de faible volume. Cette intégration technologique élimine le besoin de nettoyage répétitif de la cellule de mesure de l’instrument entre les tests, ce qui permet de gagner du temps, de réduire le risque de contamination et d’obtenir des lectures plus fiables. Un échantillon peut être préparé, scellé et prêt pour l’analyse en moins d’une minute, et ne nécessite que des volumes minimes pour une évaluation précise. Le RS-DSC de TA Instruments redéfinit le paysage des tests de stabilité thermique en analysant simultanément 24 échantillons – une nouvelle plateforme pour les tests de stabilité thermique à haut débit pour l’industrie biopharmaceutique. L’analyse thermique permet d’obtenir des informations physico-chimiques complètes et d’accélérer le développement des produits pharmaceutiques afin de les mettre sur le marché de manière efficace.

Expériences et méthodes
Herceptin® Trastuzumab a été préparé conformément aux instructions figurant sur l’emballage dans un tampon de formulation à base d’histidine (18,4 mg/mL de tréhalose dihydraté, 0,08 mg/mL de polysorbate 20, 0,49 mg/mL d’histidine HCl, 0,32 mg/mL d’histidine, pH 6,0) à 21 mg/mL et conservé à 4 °C jusqu’à son utilisation. Pour l’analyse dans une solution saline tamponnée au phosphate (PBS), l’anticorps a été échangé de tampon à l’aide d’un filtre centrifuge Amicon™ Ultra 10kDa à poids moléculaire coupé dans du PBS composé de Gibco™ DPBS avec 1 mM d’EDTA à pH 7,4, ajusté à la concentration souhaitée et testé en trois exemplaires.
Le lysozyme de blanc d’œuf de poule utilisé pour l’évaluation des solutions protéiques à haute concentration a été obtenu auprès de Sigma Aldrich (L6876) et formulé dans un tampon glycine (0,1 M glycine, pH 2,5). Les échantillons de protéines ont été concentrés à 330 mg/mL à l’aide d’un filtre centrifuge Amicon Ultra 3kDa à poids moléculaire coupé. Des dilutions ont été effectuées à partir de la solution concentrée. Les expériences ont été réalisées sur le RS-DSC de TA Instruments en trois exemplaires immédiatement après la préparation des concentrations de protéines.
L’échantillon de protéines est pipeté directement dans les puces microfluidiques jetables en verre (MFC) avec un canal conçu pour contenir 11 μL d’échantillon liquide. Après l’ajout de la solution protéique, les MFC sont scellées avec une lamelle couvre-objet en verre à dos adhésif pour contenir l’échantillon pendant le chauffage à 100 °C et sont prêtes à être placées dans le RS-DSC de TA Instruments (Figure 1). Les MFC assemblées sont placées du côté de l’échantillon de chaque calorimètre double. Une puce réutilisable en polyétheréthercétone (PEEK) reste du côté de la référence. Jusqu’à 24 échantillons peuvent être analysés simultanément avec une plage de température maximale de 20 à 100 °C et des vitesses de balayage prédéfinies de 1 ou 2 °C/min. En éliminant le besoin de nettoyage entre les analyses, il est possible d’analyser jusqu’à 96 échantillons au cours d’une journée de travail normale.
Le RS-DSC de TA Instruments, utilisé avec le logiciel RSDSCRun de TA Instruments, a été réglé pour s’équilibrer à la température initiale pendant 1 800 s avant le début de chaque analyse. Chaque échantillon a été analysé en trois exemplaires et scanné à 1 ou 2 °C/min sur toute la plage de température (20 à 100 °C).
Pour garantir la précision des 24 calorimètres, l’instrument a d’abord été étalonné et validé avec de la dipalmitoylphosphatidylcholine (DPPC), avec un décalage de Tmax accepté pour chaque calorimètre de moins de 0,2 °C par rapport à la valeur attendue dans la littérature[1].
Les données ont été traitées avec le logiciel NanoAnalyze™ (v4.0.0). Les nouvelles fonctionnalités du logiciel permettent de détecter automatiquement la température du point médian de dénaturation (Tmax) et de comparer jusqu’à 96 thermogrammes. Le logiciel NanoAnalyze v4.0.0 comprend un nouvel algorithme, RapidDSC, qui détecte automatiquement le Tmax dans les thermogrammes DSC en recherchant les pics dans la plage de données spécifiée. Une ligne de base automatique est appliquée au pic et utilisée pour affiner la température Tmax afin d’améliorer la précision. Les fonctionnalités de détection automatique des pics permettent d’afficher jusqu’à trois pics dans la plage de température concernée. Les fonctionnalités d’automatisation peuvent être facilement modifiées dans la fenêtre contextuelle « Éditeur de ligne de base et de Tmax » pour réduire la fenêtre de détection, sélectionner une gamme spécifique pour l’identification des pics, ou ajuster la ligne de base et le Tmax automatisés. Les données tabulées de l’automatisation de la Tmax peuvent être exportées pour faciliter la comparaison ou être visualisées dans les onglets de visualisation et de superposition de la Tmax dans RapidDSC.
Résultats et discussion
Limite de détection du RS-DSC de TA Instruments
Lorsque le volume d’échantillon requis est faible, il est important de comprendre les limites de concentration nécessaires à la sensibilité et à la précision des données. Des taux de balayage plus rapides entraînent une augmentation de l’intensité du signal et peuvent faciliter l’analyse des concentrations de protéines à la limite de détection ou à proximité de celle-ci. Pour comprendre les exigences de concentration d’une protéine à transition multiple, l’anticorps Herceptin Trastuzumab a été ajusté à des concentrations variables dans du PBS et évalué en trois exemplaires à une vitesse de balayage de 2 °C/min (Figure 2 et Tableau 1).
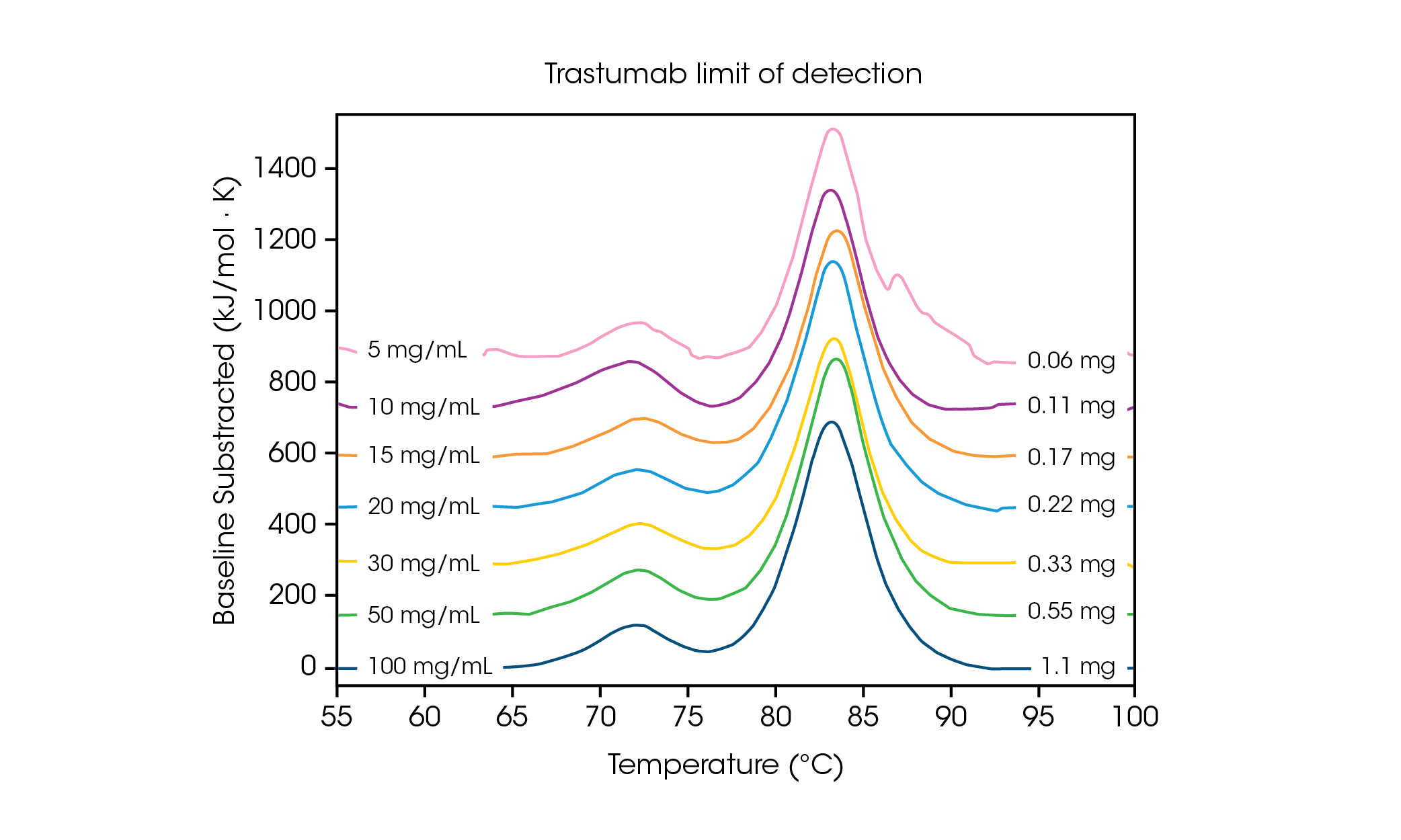
Tableau 1. Températures de transition et reproductibilité en fonction de la limite de détection. Moyenne ± SD, n = 3.
| Conc. | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 5 mg/mL | 72,57 ± 0,52 | 83,06 ± 0,09 |
| 10 mg/mL | 71,83 ± 0,29 | 82,98 ± 0,05 |
| 15 mg/mL | 72,13 ± 0,23 | 83,17 ± 0,11 |
| 20 mg/mL | 71,88 ± 0,01 | 82,99 ± 0,08 |
| 30 mg/mL | 71,91 ± 0,12 | 83,10 ± 0,03 |
| 50 mg/mL | 71,93 ± 0,08 | 83,20 ± 0,02 |
| 100 mg/mL | 71,85 ± 0,01 | 83,01 ± 0,01 |
À une concentration de 100 mg/mL, deux transitions sont clairement visibles. Elles correspondent au dépliage du domaine CH2 à une Tmax,1 moyen de 71,85 °C, et du domaine combiné Fab et CH3 à une Tmax,2 moyen de 83,01 °C [2]. Aucun changement significatif de la stabilité n’est observé lorsque la concentration de la protéine est diminuée et une excellente reproductibilité entre les calorimètres est observée. À 20 mg/mL d’Herceptin Trastuzumab, l’ampleur de la transition de dépliage CH2 est significativement diminuée, mais une excellente reproductibilité est observée sur les échantillons en triplicata (Figure 3.). En dessous de 20 mg/mL, l’analyse du domaine de dépliage CH2 plus petit devient plus difficile et une variabilité accrue de la Tmax,1 détecté est observée. Les événements de dépliage plus importants, tels que les domaines Fab et CH3 combinés (Tmax,2) sont plus facilement détectés, même à des concentrations aussi faibles que 5 mg/mL. Comme pour tous les instruments DSC, les pics les plus nets et les plus étroits offrent la meilleure reproductibilité. La limite de détection dépend de l’échantillon et peut varier en fonction de la complexité de la protéine et de l’environnement de la solution.
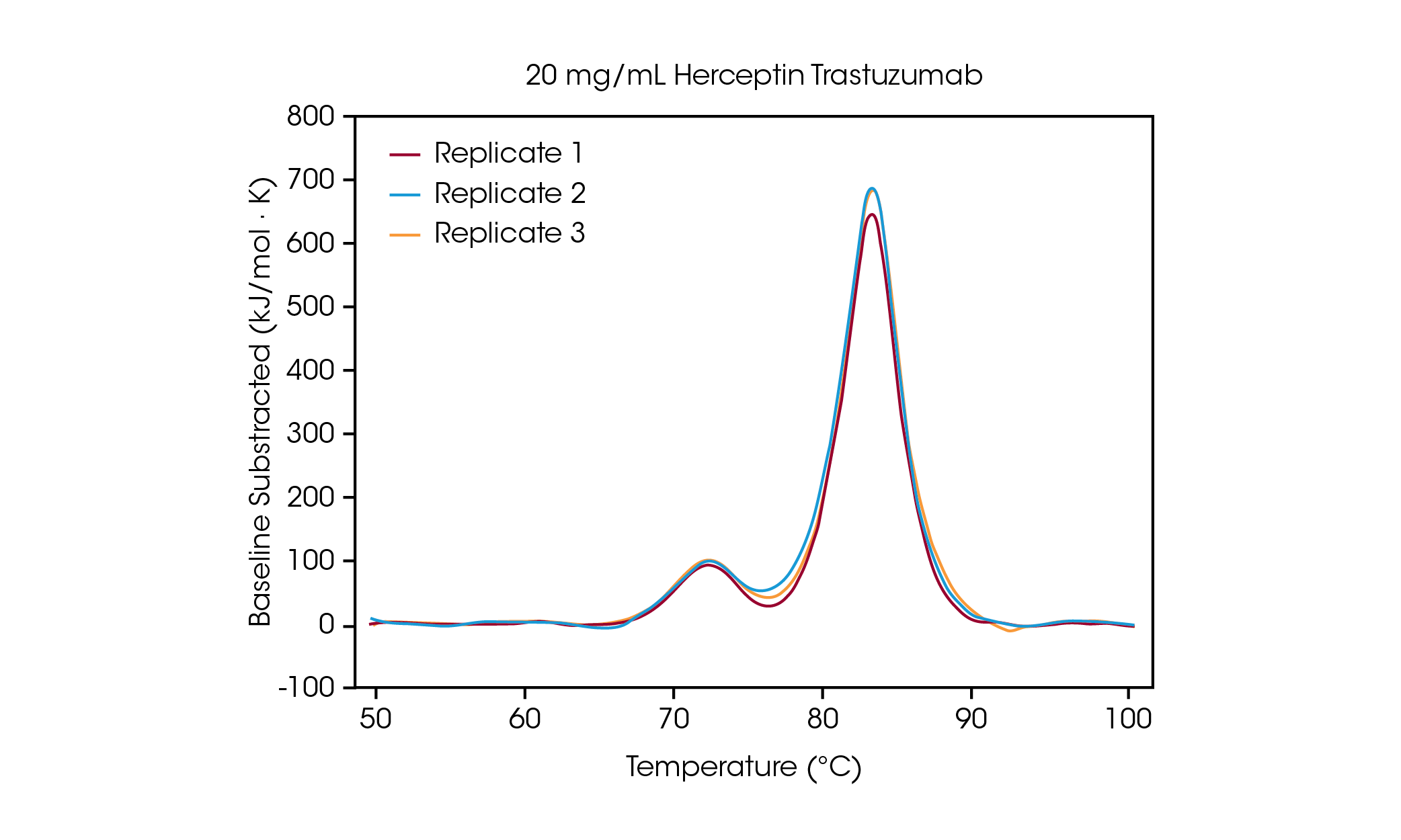
Étude de la dépendance de la concentration sur la stabilité thermique
Le RS-DSC de TA Instruments est spécialement conçu pour traiter des échantillons de médicaments biologiques à haute concentration, avec une attention particulière pour les anticorps et les conjugués anticorps-médicaments. Avec le succès croissant des thérapies à base d’anticorps, l’industrie pharmaceutique s’intéresse de plus en plus aux formes de dosage à haute concentration qui permettent l’administration de médicaments par voie sous-cutanée et oculaire. Ainsi, des concentrations de 50 à 150 mg/ml d’anticorps sont courantes, certaines peuvent aller jusqu’à plus de 200 mg/mL[3]. La formulation de protéines à des concentrations élevées peut accroître la susceptibilité à l’instabilité physique[4, 5]. Inversement, certaines études de cas ont montré une amélioration de la stabilité thermique à des concentrations plus élevées[6]. Ainsi, la compréhension du dépliement thermique et de la réponse à l’environnement de la solution à la concentration de formulation d’intérêt est une mesure critique pour atténuer le risque des produits pharmaceutiques.
Le RS-DSC de TA Instruments est conçu pour contenir des échantillons de protéines dans des puces microfluidiques jetables. Les instruments microcalorimétriques traditionnels contiennent une cellule d’échantillon fixe qui doit être nettoyée entre les expériences. Les échantillons à forte concentration susceptibles de précipiter ou de se gélifier au cours du processus de dépliage sont au mieux difficiles à nettoyer, au pire susceptibles d’endommager la cellule. En plus d’améliorer la facilité opérationnelle et d’éliminer les protocoles de nettoyage fastidieux, les puces microfluidiques jetables utilisées dans le RS-DSC de TA Instruments permettent de tester sans risque des échantillons de protéines à haute concentration.
Pour démontrer la capacité à tester des échantillons de protéines à haute concentration et illustrer l’importance de tester la concentration de formulation souhaitée, nous avons évalué le lysozyme de blanc d’œuf de poulet de 30 à 330 mg/mL dans un tampon de glycine (Figure 4 et Tableau 2). Avec un thermogramme de transition simple à de faibles concentrations (~1 mg/mL), le lysozyme est couramment utilisé comme échantillon de référence pour la DSC. En évaluant des concentrations de protéines jusqu’à 100 fois plus élevées, nous avons observé une dépendance de la concentration sur la stabilité du lysozyme.
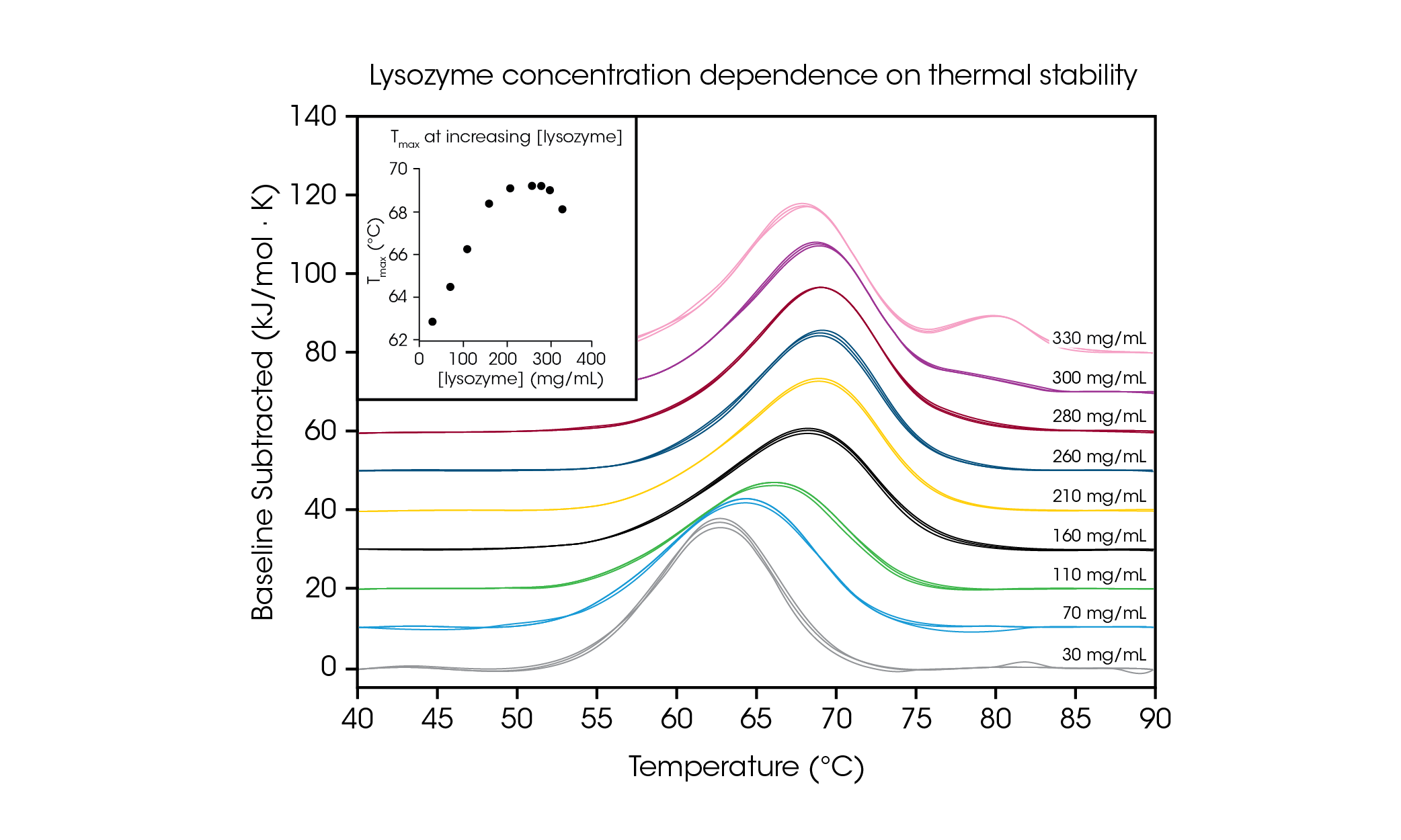
Tableau 2. Températures de transition et reproductibilité en fonction de la dépendance de la concentration du lysozyme. Moyenne ± SD, n = 3.
| Conc. | Tmax (°C) |
|---|---|
| 330 mg/mL | 68,14 ± 0,05 |
| 300 mg/mL | 69,00 ± 0,04 |
| 280 mg/mL | 69,22 ± 0,04 |
| 260 mg/mL | 69,19 ± 0,09 |
| 210 mg/mL | 69,08 ± 0,06 |
| 160 mg/mL | 68,39 ± 0,04 |
| 110 mg/mL | 66,27 ± 0,09 |
| 70 mg/mL | 64,68 ± 0,05 |
| 30 mg/mL | 62,81 ± 0,06 |
À la plus faible concentration testée, 30 mg/mL, la Tmax du lysozyme a été mesuréa à 62,81 °C. Lorsque la concentration a augmenté jusqu’à 160 mg/mL, la stabilité a augmenté de façon linéaire (voir Figure 4 en médaillon) jusqu’à une Tmax de 68,39 °C. Entre 210 et 280 mg/mL, la stabilité thermique a atteint un plateau à une Tmax d’environ 69,2 °C. Il est intéressant de noter qu’à une concentration de 300 mg/mL, la présence d’un épaulement à la queue de la transition principale commence à être observée autour de 80 °C et la stabilité globale de la transition principale diminue légèrement avec une Tmax de 69,00 °C. À la concentration la plus élevée de 330 mg/mL, la stabilité thermique de la transition principale Tmax,1 diminue encore à 68,14 °C et un pic supplémentaire est observé avec une Tmax,2 de 80,28 ± 0,04 °C. Grâce à sa capacité à tester des concentrations élevées, le RS-DSC de TA Instruments permet d’observer la formation de structures d’ordre supérieur à des concentrations de lysozyme supérieures à ~300 mg/mL. En plus de démontrer la capacité d’acquérir des données de haute qualité à des concentrations élevées de protéines, cette étude démontre l’importance de tester les médicaments biologiques à la concentration d’intérêt, car la dilution peut altérer la stabilité observée de la protéine.
Conclusions
La technologie DSC traditionnelle à échantillon unique est très précise mais nécessite de grands volumes d’échantillons et peut être une technique chronophage dans le processus de développement des médicaments. Le RS-DSC de TA Instruments permet de réaliser des tests de stabilité thermique à plus haut débit grâce à l’analyse simultanée d’un maximum de 24 échantillons. Un flux de travail plus facile, un taux d’acquisition de données plus élevé grâce à des tests parallèles et une analyse plus rapide grâce à des algorithmes de détection de pics automatisés améliorent de manière significative le temps d’obtention des résultats. Nous démontrons ici une analyse précise et reproductible d’échantillons d’anticorps à transition complexe et multiple jusqu’à 20 mg/mL. La vitesse de balayage plus rapide de 2 °C/min permet d’obtenir des signaux de plus grande amplitude, ce qui peut faciliter l’analyse des échantillons à la limite de détection ou à proximité de celle-ci. L’étude de solutions de lysozyme à haute concentration, jusqu’à 330 mg/mL, révèle une dépendance inattendue de la concentration sur la stabilité thermique et souligne l’importance de l’évaluation de la concentration du produit médicamenteux d’intérêt. Dans l’ensemble, le RS-DSC de TA Instruments fournit une nouvelle plateforme pour caractériser la stabilité des produits biothérapeutiques — une variable importante pour comprendre la résilience au stress thermique et la qualité des produits et pour soutenir l’approbation réglementaire.
Références
- « Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters », ASTM E2603-15, 2023.
- K. J. Arlotta, A. V. Gandhi, H.-N. Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, « In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution », Antibodies, vol. 7, p. 6, 2018.
- R. G. Strickley and W. J. Lambert, « A review of formulations of commercially available antibodies », Journal of Pharmaceutical Sciences, vol. 110, pp. 2590-2608, 2021.
- J. Zarzar, T. Khan, M. Bhagawati, B. Weiche, J. Syndow-Andersen and S. Alavattam, « High concentration formulation developability approaches and considerations », MAbs, vol. 15, pp. 1-13, 2023.
- S. J. Shire, Z. Shahrokh and J. Liu, « Challenges in the development of high protein concentration formulations », Journal of Pharmaceutical Sciences, vol. 93, pp. 1390-1402, 2004.
- C. Zhang, J. W. Bye, L. H. Lui, H. Zhang, J. Hales, S. Brocchini, R. A. Curtis and P. A. Dalby, « Enhanced Thermal Stability and Reduced Aggregation in an Antibody Fab Fragment at Elevated Concentrations », Molecular Pharmaceutics, vol. 20, pp. 2650-2661, 2023.
Cliquez ici pour télécharger la version imprimable de cette note d’application.

