Mots clés : Calorimétrie différentielle à balayage, anticorps monoclonaux (mAb), produits médicamenteux à base d’anticorps, stabilité thermique à court terme, haut débit, développement de formulations
MC178-FR
Résumé
Les tests de stabilité thermique à court terme sont essentiels pour garantir la qualité des produits et obtenir l’approbation des autorités réglementaires pour les produits pharmaceutiques à base d’anticorps. Le RS-DSC (Calorimètre à balayage différentiel pour le dépistage rapide) de TA Instruments™ permet le dépistage de la stabilité thermique des formulations de tampons et des modifications de séquences protéiques. L’instrument fournit une plateforme pour l’analyse simultanée d’un maximum de 24 échantillons à des concentrations similaires à celles des formulations. Cette note d’application fournit des données qui illustrent l’utilité du RS-DSC de TA Instruments pour permettre le dépistage de la stabilité thermique à court terme des tampons et l’analyse des modifications des protéines pour le développement de produits pharmaceutiques à base d’anticorps.
Introduction
Il est fondamental de connaître la relation structure-fonction des anticorps pour comprendre comment les variations fonctionnelles apparaissent, qu’elles soient dues à des altérations des conditions de solution ou à des modifications de séquence. La caractérisation de la structure des anticorps est une étape importante dans la délimitation de ces différences. En outre, l’évaluation de la stabilité des biomolécules dans des conditions thermiques variables est cruciale pour garantir la qualité et l’approbation réglementaire de ces produits pharmaceutiques.La
calorimétrie différentielle à balayage (DSC) est une technique thermique utilisée pour comprendre la structure des anticorps et évaluer la résistance d’un composé au stress thermique. La calorimétrie différentielle à balayage (DSC) est une technique thermique utilisée pour comprendre la structure des anticorps et évaluer la résistance d’un composé au stress thermique. Il s’agit d’une mesure clé employée dans la sélection des candidats et la préformulation, et d’un paramètre important dans la sélection de la composition des tampons, y compris les excipients, les sels tampons, les détergents et le pH dans le développement des formulations cliniques. En raison de la nature de ce dépistage, il est courant d’avoir entre des dizaines et des centaines d’échantillons qui doivent être analysés. Les études DSC traditionnelles sont lentes, car elles ne permettent de tester qu’un échantillon à la fois et nécessitent un nettoyage méticuleux entre les échantillons pour obtenir les meilleurs résultats. Le RS-DSC de TA Instruments – une nouvelle plateforme pour les tests de stabilité thermique à haut débit – redéfinit le paysage des tests de stabilité thermique en analysant simultanément 24 échantillons. Fournir des informations physicochimiques rapides et complètes grâce à l’analyse thermique permettrait de réduire les coûts et les délais de mise sur le marché de nouveaux médicaments.
Les thermogrammes DSC pour les anticorps sont particulièrement variés. Certains anticorps présentent un seul pic, tandis que d’autres présentent plusieurs pics distincts ou des pics qui se chevauchent et qui se manifestent comme des épaulements sur un pic plus large qui se déploie. Il a été suggéré que la variété de ces thermogrammes est en corrélation avec la flexibilité de la région charnière[1]. Des études sur les protéines à plusieurs domaines indiquent que ces pics complexes qui se chevauchent peuvent résulter d’interactions entre les domaines[2]. Des études DSC avancées ont même permis de déterminer avec précision la température de dépliage de domaines individuels dans la partie de la chaîne lourde des anticorps[3]. Le but ultime de ces études est de vérifier la stabilité thermique, car une mauvaise stabilité peut avoir un impact significatif sur la solubilité, qui peut conduire à l’agrégation, un problème courant dans les produits biothérapeutiques.

Expériences et méthodes
Herceptin™ Trastuzumab a été préparé conformément aux instructions figurant sur l’emballage dans un tampon de formulation à base d’histidine (18,4 mg/mL de tréhalose dihydraté, 0,08 mg/mL de polysorbate 20, 0,49 mg/mL d’histidine HCl, 0,32 mg/mL d’histidine, pH 6,0) à 21 mg/mL et conservé à 4 °C jusqu’à son utilisation. Pour l’analyse dans différents tampons, l’anticorps a été échangé sur les tampons à l’aide d’un filtre centrifuge Amicon™ Ultra 10kDa à poids moléculaire coupé.
Le tampon borate était composé de 50 mM d’acide borique, 50 mM de NaCl, 2 mM d’EDTA à pH 8,0. Le PBS, tampon de travail courant, était composé de Gibco™ DPBS avec 1 mM EDTA à pH 7,4. Le tampon de formulation au succinate utilisé pour KADCYLA™, un conjugué anticorps-médicament développé à partir de l’échafaudage d’anticorps trastuzumab, était composé de succinate de sodium 10 mM, 6 % de saccharose p/v, pH 5,0.
Les échantillons d’anticorps pour le dépistage des mutations ont été conçus et fournis par Cell Signaling Technology et formulés dans du PBS (pH 7,4) à 20 mg/ml pour l’analyse.
L’échantillon de protéines est pipeté directement dans les puces microfluidiques jetables en verre (MFC) avec un canal conçu pour contenir 11 μL d’échantillon liquide. Après l’ajout de la solution protéique, les puces microfluidiques sont scellées à l’aide de lamelles de verre adhésives afin de contenir l’échantillon pendant le chauffage à 100 °C. Les MFC assemblées sont placées du côté de l’échantillon de chaque calorimètre double dans le RS-DSC de TA Instruments (Figure 1). Une puce réutilisable en polyétheréthercétone (PEEK) reste du côté de la référence. Jusqu’à 24 échantillons peuvent être analysés simultanément avec une plage de température de 20 à 100 °C et des vitesses de balayage prédéfinies de 1 ou 2 °C/min. En éliminant le besoin de nettoyage entre les analyses, il est possible d’analyser jusqu’à 96 échantillons au cours d’une journée de travail normale.
Le RS-DSC de TA Instruments, utilisé avec le logiciel RS-DSCRun, a été réglé pour s’équilibrer à la température initiale pendant 1 800 s avant le début de chaque analyse. Chaque échantillon a été analysé en trois exemplaires et scanné à 1 ou 2 °C/min sur toute la plage de température (20 à 100 °C).
Pour garantir la précision des 24 calorimètres, l’instrument a d’abord été étalonné et validé avec de la dipalmitoylphosphatidylcholine (DPPC), avec un décalage de Tmax accepté de moins de 0,2 °C par rapport à la valeur attendue dans la littérature[4].
Les données ont été traitées avec le logiciel NanoAnalyze™ (v4.0.0). Les nouvelles fonctionnalités du logiciel NanoAnalyze permettent de détecter automatiquement la température du point médian de dénaturation (Tmax) et de comparer jusqu’à 96 thermogrammes. Le logiciel NanoAnalyze v4.0.0 comprend un nouvel algorithme, RapidDSC, qui détecte automatiquement la Tmax dans les thermogrammes DSC en recherchant les pics dans la plage de données spécifiée. Une ligne de base automatique est appliquée au pic et utilisée pour affiner la température Tmax afin d’améliorer la précision. Les fonctionnalités de détection automatique des pics permettent d’afficher jusqu’à trois pics dans la plage de température concernée. Les fonctionnalités d’automatisation peuvent être facilement modifiées dans la fenêtre contextuelle « Éditeur de ligne de base et de Tmax » pour réduire la fenêtre de détection, sélectionner une gamme spécifique pour l’identification des pics, ou ajuster la ligne de base et le Tmax automatisés. Les données tabulées de l’automatisation de la Tmax peuvent être exportées pour faciliter la comparaison ou être visualisées dans les onglets de visualisation et de superposition de la Tmax dans RapidDSC.
Une analyse manuelle dans le logiciel NanoAnalyze a été effectuée pour comparaison avec la Tmax automatisée détectée avec RapidDSC. Pour la comparaison manuelle avec les caractéristiques de détection automatisée des pics, chaque balayage individuel a été normalisé à la capacité thermique molaire en utilisant les moles de protéines dans le volume cellulaire actif. Un polynôme de quatrième ou cinquième ordre a été appliqué comme ligne de base aux données normalisées. La Tmax a été estimée visuellement et comparée à la sortie automatisée du Tmax pour chaque transition. Une analyse plus poussée des thermogrammes peut être complétée par un ajustement avec des modèles comme décrit dans « NanoDSC : What to Consider when Choosing a Baseline and Model (NanoDSC : éléments à prendre en compte lors du choix d’une ligne de base et d’un modèle) »[5]. Pour l’analyse de la stabilité des anticorps, l’utilisation des modèles de Voigt est recommandée.
Résultats et discussion
Criblage du tampon de formulation
La stabilité thermique est une caractéristique de qualité essentielle d’un médicament biologique. La DSC est le principal outil mis en œuvre pour caractériser l’effet de l’environnement de la solution sur la stabilité des protéines. La stabilité des protéines est influencée par une série de variables dans l’environnement de la solution, telles que le pH, le type de tampon, la force ionique, les excipients et les détergents. Ces effets peuvent être observés sous la forme d’un léger décalage de la Tmax ou de changements plus importants pouvant aller jusqu’à des dizaines de degrés [6]. Conçu pour répondre aux besoins de l’industrie biopharmaceutique, le débit parallèle du RS-DSC de TA Instruments facilite le criblage des conditions de solution pour les protéines biologiques médicamenteuses, ce qui améliore le temps de décision par rapport
aux méthodes microcalorimétriques traditionnelles.
Pour démontrer comment les données issues du criblage de la formulation peuvent aider à la sélection des composants du tampon, nous avons analysé les données en trois exemplaires de l’anticorps Herceptin Trastuzumab dans quatre conditions de tampon courantes (Figure 2 et Tableau 1). Pour cette étude, les anticorps dans différents tampons de formulation ont été criblés à ~ 20 mg/mL ; cependant, le RS-DSC de TA Instruments est conçu de manière unique pour traiter des concentrations de protéines de formulation allant jusqu’à plus de 330 mg/mL, ce qui permet de tester la stabilité thermique d’un produit pharmaceutique non dilué. Pour plus d’informations, voir la note d’application de TA Instruments « Dépistage rapide de la stabilité thermique des médicaments biologiques à haute concentration »[7].
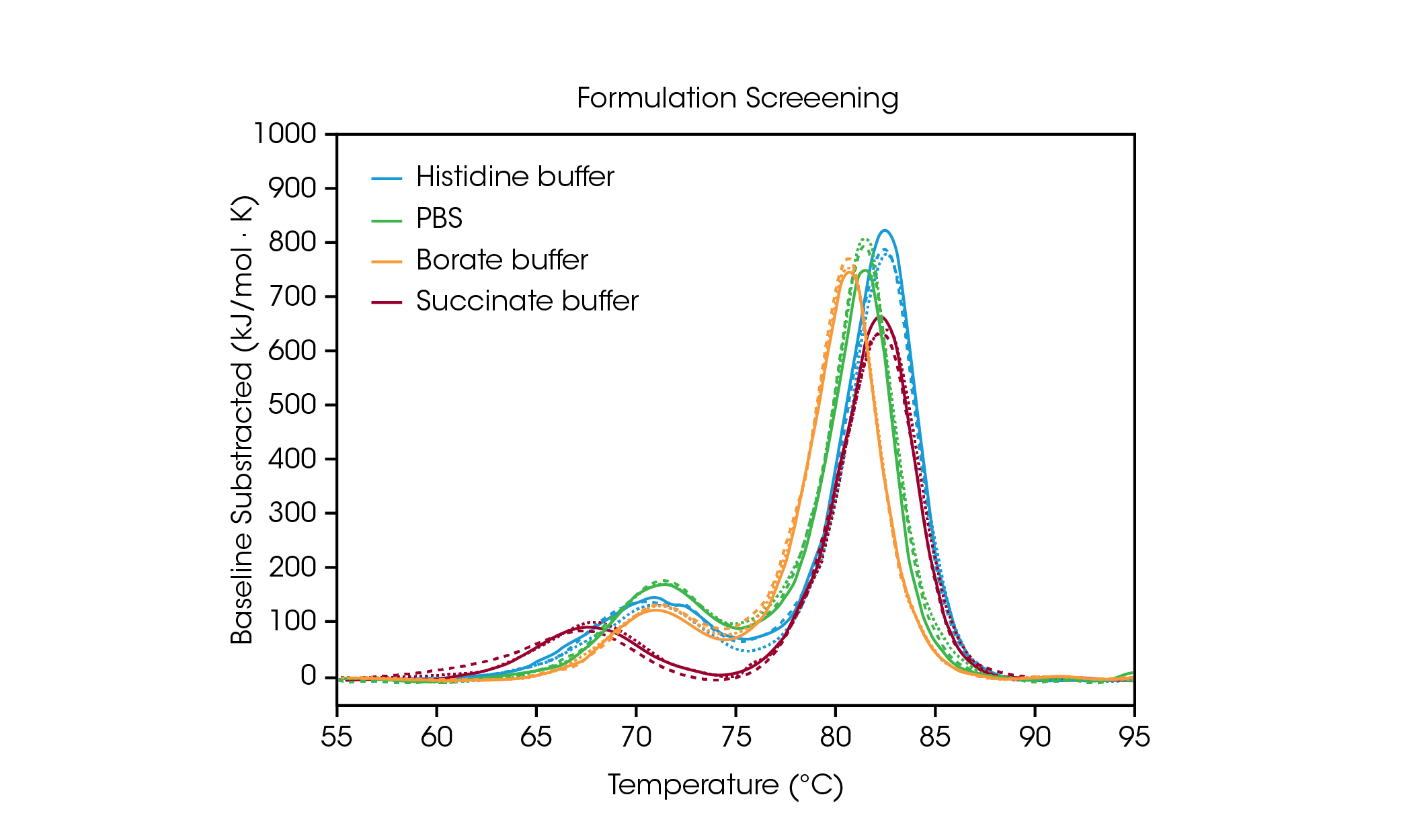
Tableau 1. Températures de transition pour la sélection de formulation. Moyenne ± SD, n = 3.
| Tampon | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| Histidine | 70,76 ± 0,38 | 82,66 ± 0,09 |
| Borate | 70,84 ± 0,08 | 80,69 ± 0,02 |
| PBS | 71,12 ± 0,06 | 81,48 ± 0,02 |
| Succinate | 67,71 ± 0,22 | 82,66 ± 0,08 |
Le premier événement de dépliage, correspondant au dépliage du domaine CH2, n’est pas significativement affecté par les tampons histidine, borate ou PBS[8]. Cependant, le tampon succinate déstabilise le domaine CH2, ce qui entraîne une diminution du début du dépliage et de Tmax,1 d’environ 3 °C. En ce qui concerne la transition principale reflétant les événements de dépliage Fab et CH3, les tampons histidine et succinate sont les plus stabilisants, avec une Tmax,2 de 82,66 °C. La transition principale est la moins stable dans le tampon borate avec une Tmax,2 de 80,69 °C. Sans surprise, la formulation tampon la plus stabilisante pour le trastuzumab dans cet ensemble d’échantillons est le tampon d’histidine utilisé pour la formulation finale du produit pharmaceutique approuvé.
Pour faciliter l’analyse des données du criblage de formulation, la détection automatisée de la Tmax dans le logiciel NanoAnalyze permet de détecter avec précision jusqu’à trois transitions dans les criblages de stabilité des protéines. Pour démontrer la précision de l’algorithme de sélection des pics, les Tmax,1 et Tmax,2 automatiques pour le trastuzumab à 50 mg/mL dans un tampon de formulation à base d’histidine sont comparées à la sélection manuelle des pics et sont décrits dans la Figure 3 et le Tableau 2. Pour l’analyse automatisée, deux pics ont été détectés après l’application d’un polynôme de ligne de base de quatrième ordre à l’aide de la fonction de détection automatique des crochets de démarrage, qui ne nécessite pas la spécification de la plage de température d’intérêt.
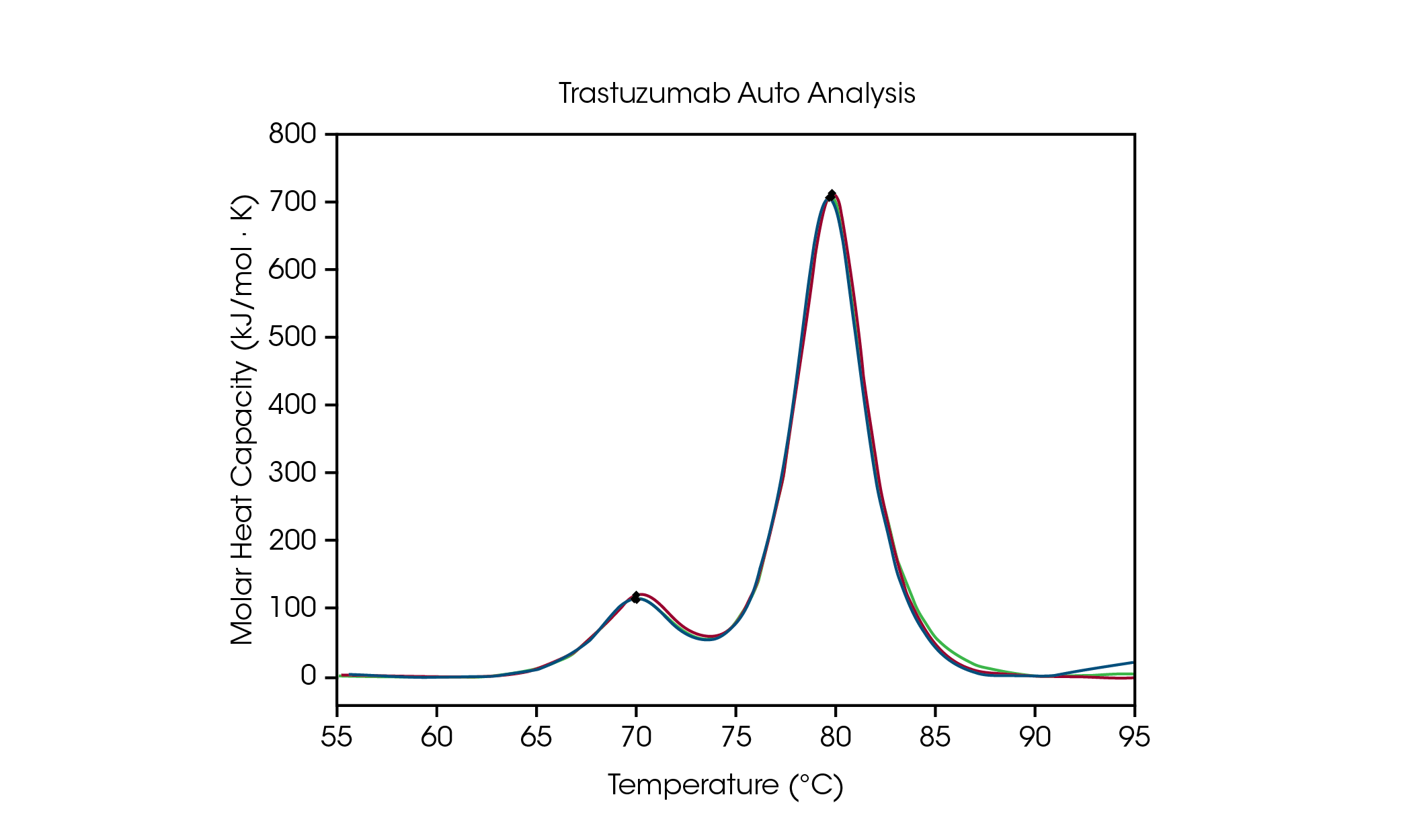
Tableau 2. Comparaison entre la détection automatisée et manuelle du Tmax pour le trastuzumab.
| Échantillon | Tmax,1 automatique (°C) | Tmax,1 manuel (°C) | Tmax,2 automatique (°C) | Tmax,2 manuel (°C) |
|---|---|---|---|---|
| Essai 1 | 71,93 | 72.04 | 82,92 | 82,88 |
| Essai 2 | 71,81 | 71,93 | 82,76 | 82,75 |
| Essai 3 | 71,93 | 71,97 | 82,90 | 82,83 |
| Moyenne | 71,89 ± 0,07 | 71,98 ± 0,06 | 82,86 ± 0,09 | 82,82 ± 0,07 |
Le dépliage du domaine CH2 a un Tmax,1 automatisé de 71,89 °C comparé à 71,98 °C pour l’analyse manuelle des pics. La transition principale a une Tmax,2 automatisée de 82,86 °C comparée à 82,82 °C pour l’analyse manuelle des pics. Une excellente reproductibilité est observée pour le trastuzumab. Lorsque testée sur trois essais, la Tmax des deux pics se situe dans les limites de précision de l’instrument de ± 0,2 °C, en utilisant à la fois l’analyse manuelle et l’analyse automatisée des pics. Une inspection visuelle est toujours recommandée pour assurer une compréhension complète des données. Cet ensemble de données démontre que les fonctionnalités d’analyse automatisées de la DSC permettent une détection précise de la Tmax dans les thermogrammes à transitions multiples.
Criblage des modifications de séquence
Les mutations protéiques sont une stratégie courante pour optimiser la structure et la fonction des protéines, et même les modifications d’un seul acide aminé peuvent avoir un effet mesurable sur la stabilité globale de la protéine. La DSC est utilisée pour comprendre l’impact d’une mutation sur la stabilité thermique d’une protéine et peut aider à guider la prise de décision dans le pipeline de développement de médicaments biologiques. Pour démontrer les types d’effets qu’une modification de séquence peut avoir sur la stabilité, un petit panel d’anticorps modifiés a été examiné pour déterminer les changements dans le dépliage thermique qui résultent d’une mutation d’un seul acide aminé dans la séquence de la protéine (Figure 4 et Tableau 3).
Dans l’anticorps parent, le dépliage des domaines CH2, Fab et CH3 est contenu dans une transition thermique majeure à une Tmax de 75,92 °C. À partir de la protéine mère, une mutation d’un seul acide aminé a été effectuée, qui n’a pas d’effet majeur sur la stabilité thermique à court terme (Mutation 1), avec une Tmax de 75,52 °C. Cependant, d’autres mutations d’un seul acide aminé ont un impact significatif sur la stabilité de la protéine (Mutation 2 et Mutation 3). La présence d’un épaulement évident est observée dans la mutation 2, qui correspond probablement à une déstabilisation dans le domaine CH2 avec une Tmax,1 ajoutée de 70,04 °C couplée à un petit décalage de la transition principale par rapport à la protéine mère avec une Tmax,2 de 75,14 °C. La mutation 3 entraîne une déstabilisation importante du domaine CH2, ce qui se traduit par un pic de dépliage supplémentaire complet avec une Tmax,1 de 64,85 °C. La transition principale est relativement peu affectée avec une Tmax,2 de 75,29 °C. Comme l’illustre la déstabilisation significative de la Mutation 3, la modification n’a pas toujours le même effet, car ce dernier dépend à la fois du site de la modification et des propriétés physicochimiques du nouvel acide aminé. L’optimisation des avantages fonctionnels souhaités de la modification de la séquence avec la stabilité structurelle de la protéine aide à comprendre la relation structure-fonction et peut faciliter le développement de thérapies avancées.
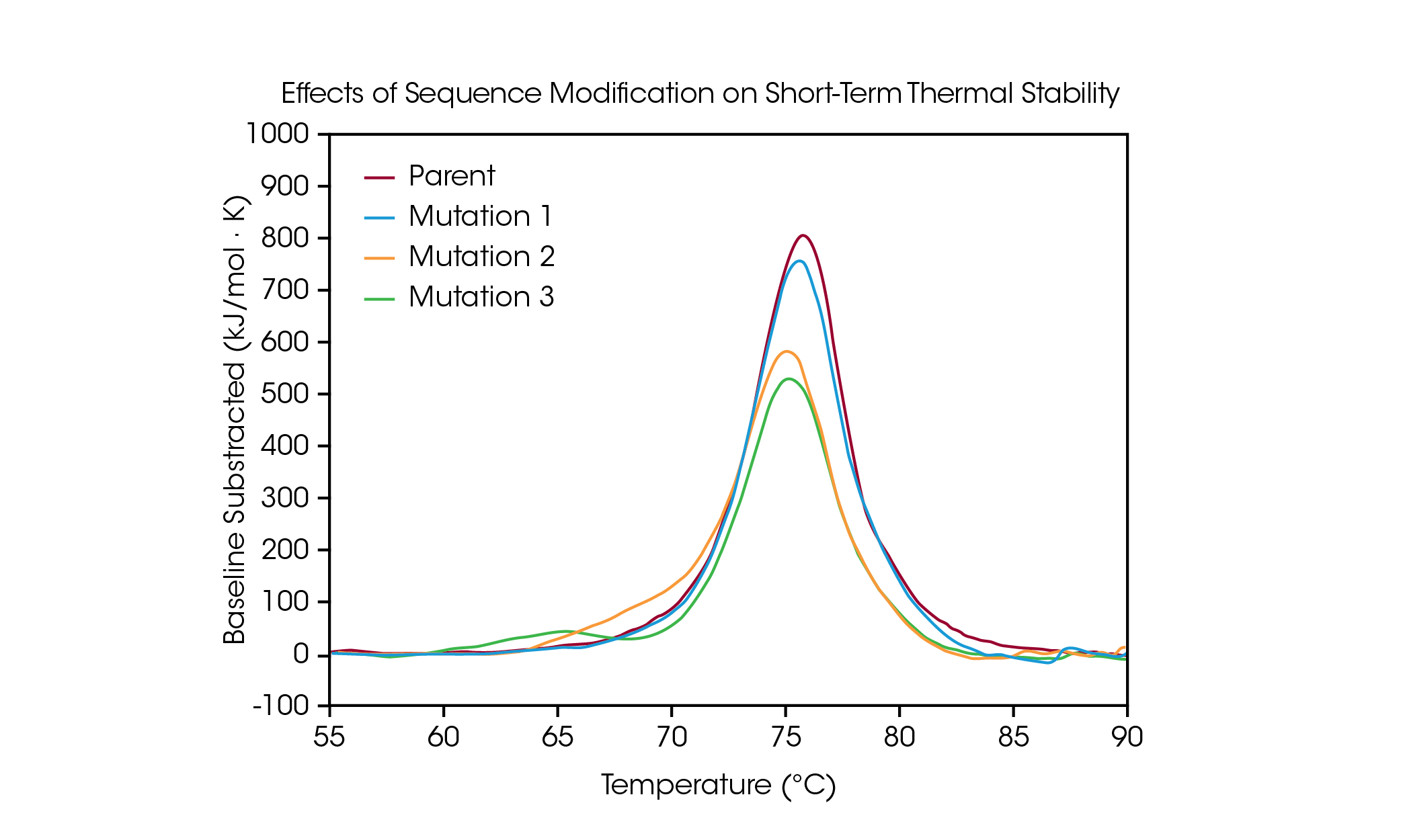
Tableau 3. Température de transition pour le criblage de mutation. Moyenne ± SD, n = 3. *Déterminé par le modèle de Voigt.
| Échantillon | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| Parent | — | 75,92 ± 0,15 |
| Mutation 1 | — | 75,52 ± 0,14 |
| Mutation 2 | 70,04 ± 0,86* | 75,14 ± 0,06 |
| Mutation 3 | 64,85 ± 0,05* | 75,29 ± 0,06 |
Conclusions
L’analyse de l’impact de l’environnement de la solution et de la modification de la séquence sur la stabilité thermique à court terme est essentielle pour le développement de produits pharmaceutiques de haute qualité. Le RS-DSC de TA Instruments permet un criblage à haut débit de la stabilité thermique en testant simultanément jusqu’à 24 échantillons, ce qui améliore considérablement le temps de prise de décision. Nous démontrons ici une analyse précise et reproductible d’échantillons d’anticorps à transition complexe et multiple, ainsi que la détermination rapide de l’impact des composants tampons et des mutations sur la structure globale de la protéine. De nouveaux algorithmes dans le logiciel de traitement des données, NanoAnalyze, facilitent l’analyse de grandes quantités de données thermiques désormais accessibles avec le criblage à haut débit. Dans l’ensemble, le RS-DSC de TA Instruments fournit une nouvelle plateforme pour caractériser la stabilité des anticorps — une variable importante pour comprendre la résilience au stress thermique et la qualité des produits et pour soutenir l’approbation réglementaire.
Références
- V. T. Oi, T. M. Vuong, R. Hardy, J. Reidler, J. Dangl, L. A. Herzenberg and L. Stryer, « Correlation between segmental flexibility and effector function of antibodies », Nature, vol. 307, pp. 136-140, 1984.
- P. L. Privalov and S. A. Potekhin, « Scanning microcalorimetry in studying temperature-induced changes in proteins », Methods in Enzymology, vol. 131, pp. 5-51, 1986.
- J. Wen, Y. Jiang and L. Nahri, « Effect of Carbohydrate on Thermal Stability of Antibodies », American Pharmaceutical Review, vol. 11, p. 98, 2008.
- « Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters », ASTM E2603-15, 2023.
- « NanoDSC: What to Consider when Choosing a Baseline and Model », TA Instruments, MC154.
- C. M. Johnson, « Differential scanning calorimetry as a tool for protein folding and stability », Archives of Biochemistry and Biophysics, vol. 531, pp. 100-109, 2013.
- « Rapid Thermal Stability Screening of High Concentration Biologic Drugs », TA Instruments, MC177.
- K. J. Arlotta, A. V. Gandhi, H.-N. Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, « In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution », Antibodies, vol. 7, p. 6, 2018.
Cliquez ici pour télécharger la version imprimable de cette note d’application.

