키워드: 시차 주사 열량계, 시차 주사 열량 측정법, 단일클론항체(mAb), 항체 약물 제품, 단기 열 안정성, 고처리량, 제형 개발
MC178-KO
초록
단기 열 안정성 테스트는 항체 제품의 제품 품질을 보장하고 규제 승인을 지원하는 데 중요하다. TA Instruments™ RS-DSC(신속 스크리닝-시차 주사 열량계)는 완충액 제형 및 단백질 서열 변형의 열 안정성 스크리닝을 제공한다. 이 기기는 제형 강도 농도에서 샘플 최대 24개를 동시에 분석할 수 있는 플랫폼을 제공한다. 이 애플리케이션 노트에서는 완충액의 단기 열 안정성 스크리닝 및 항체 약물 제품 개발을 위한 단백질 변형 분석을 가능하게 하는 TA Instruments RS-DSC의 유용성을 설명하는 데이터를 제공한다.
서론
항체의 구조-기능 관계에 대한 이해는 용액 조건의 변화나 단백질 서열의 변형으로 인해 기능적인 변화가 나타나는 방식을 파악하는 데 필수적이다. 항체 구조의 특성 규명은 이러한 차이를 설명하는 중요한 단계이다. 또한 다양한 열 조건에서의 생체분자 안정성을 평가하는 것은 의약품의 품질과 규제 승인을 확보하는 데 중요하다.
시차 주사 열량 측정법(DSC)은 항체 구조를 파악하고 화합물의 열응력 저항을 평가하는 열 관련 기술이다. 단기 열 안정성은 항체 약물 제품 평가에서 중요한 품질 특성이다. 이는 후보 물질 선정 및 제형 확정 전 단계에 사용되는 중요 지표이며, 임상 제형 개발 시 부형제, 완충염, 계면활성제 및 pH를 포함한 완충액 구성 요소를 선정하는 데 중요한 매개 변수이다. 이 스크리닝의 특성으로 인해 수십에서 수백 개의 샘플에 대한 테스트를 실행하고 분석해야 하는 경우가 일반적이다. 기존의 DSC 연구는 속도가 느리며 한 번에 하나의 샘플만 테스트할 수 있고, 최상의 결과를 내기 위해서는 샘플 간 꼼꼼한 세척이 필요한다. 고처리량 열 안정성 테스트를 위한 새로운 플랫폼인 TA Instruments RS-DSC은 24개 샘플을 동시에 분석하여 열 안정성 테스트 환경에 새로운 지평을 열었다. 열 분석을 통해 빠르고 포괄적인 물리화학적 통찰력을 제공하면 신약이 시장에 출시되기까지의 비용과 시간을 줄일 수 있다.
항체의 DSC 열영상은 아주 다양하다. 일부 항체는 단일 피크가 표시되는 반면 여러 개의 피크를 보이거나 더 큰 풀림 피크의 숄더 형태로 나타나는 중첩된 피크를 보이는 항체도 있다. 이러한 열영상의 다양성은 힌지 영역의 유연성과 상관 관계가 있다는 의견이 제시되었다[1]. 다중 도메인 단백질 연구에 따르면 이처럼 복잡하게 중첩된 피크는 도메인 간 상호작용으로 인해 발생한 것일 수 있다[2]. 고급형 DSC 연구에서는 항체의 중쇄 부분에 있는 개별 도메인의 풀림 온도를 성공적으로 밝기기도 했다[3]. 열악한 안정성은 용해도에 큰 영향을 미치며 생물약제에서 흔히 발생하는 문제인 응집을 일으킬 수 있으므로 이러한 연구의 궁극적인 목표는 열 안정성을 확인하는 것이다.

실험 및 방법
Herceptin™ 트라스투주맙을 패키지 지침에 따라 21 mg/mL의 히스티딘 제형 완충액(트레할로스 이수화물 18.4 mg/mL, 폴리소르베이트 20 0.08 mg/mL, 히스티딘 HCl 0.49 mg/mL, 히스티딘 0.32 mg/mL, pH 6.0)에 준비한 후 사용하기 전까지 4 °C에서 보관했다. 다양한 완충액에서의 분석을 위해 Amicon™ Ultra 10kDa 분자량 원심분리 스핀 필터를 이용하여 항체 완충액의 교환을 실시했다.
붕산염 완충액은 pH 8.0의 붕산 50 mM, NaCl 50 mM, EDTA 2 mM로 구성되었다. 일반적인 작업 완충액인 PBS는 pH 7.4의 EDTA 1 mM이 포함된 PBS Gibco™ DPBS로 구성되었다. 트라스투주맙 항체 스캐폴드에 구축된 항체 약물 접합체인 KADCYLA™에 사용된 숙신산염 제형 완충액은 pH 5.0의 6% w/v 설탕 및 숙신산나트륨 10 mM으로 구성되었다.
돌연변이 샘플을 스크리닝하기 위한 항체 샘플은 Cell Signaling Technology에서 제작 및 공급되었으며 분석을 위해 20 mg/mL PBS(pH 7.4)에서 제형화되었다.
단백질 샘플을 액체 샘플 11 μL를 함유할 수 있도록 설계된 채널이 있는 일회용 유리 미세유체 칩(MFC)으로 피펫을 이용해 직접 옮긴다. 단백질 용액을 추가한 후 100 °C까지 가열하는 동안 샘플을 함유할 수 있도록 미세유체 칩을 접착력이 있는 유리 커버슬립으로 밀봉한다. 조립한 MFC는 TA Instruments RS-DSC의 각 트윈 열량계의 샘플 면에 배치한다(그림 1). 재사용 가능한 폴리에텔에텔케톤(PEEK) 칩은 기준 면에 남겨 둔다. 온도 범위 20~100 °C, 사전 설정 스캔 속도 1~2 °C/분을 이용하여 최대 24개 샘플을 동시에 실험할 수 있다. 스캔 사이에 세척할 필요가 없으므로, 일반적인 근무일에 최대 96개 샘플을 실행할 수 있다.
RSDSCRun 소프트웨어로 작동되는 TA Instruments RS-DSC는 각 스캔을 시작하기 전 1800초간 초기 온도에서 평형을 이루도록 설계되었다. 각 샘플은 전체 온도 범위(20~100 °C)에 걸쳐 1 또는 2 °C/분으로 3회 반복 스캔했다.
24개 열량계 전체의 정확성을 확보하기 위해 기기는 우선 디팔미토일포스파티딜콜린(DPPC)으로 보정 및 검증되었으며 허용된 Tmax 변동은 예상 문헌 수치에 따르면 0.2 °C 미만이었다[4].
데이터는 NanoAnalyze™ Software(v4.0.0)로 처리되었다. NanoAnalyze Software의 새로운 기능을 사용하면 변성 중간점 온도(Tmax)를 자동으로 감지하고 최대 96개 열영상을 비교할 수 있다. NanoAnalyze Software v4.0.0에는 지정된 데이터 범위에서 피크를 찾아 DSC 열영상에서 자동으로 Tmax를 감지하는 새로운 소프트웨어 알고리즘인 RapidDSC가 포함되어 있다. 피크 전체에 자동 기준선이 적용되며, 정확도를 개선하기 위해 Tmax온도를 세분화하는 데 사용된다. 자동 피크 감지 기능은 관심 온도 범위 내에서 최대 3개 피크를 표시한다. 자동화 기능은 “기준선 및 Tmax 편집기” 팝업 창에서 손쉽게 편집하여 감지 창을 좁히고, 피크 식별을 위한 특정 범위를 선택하거나 자동화된 기준선 및 Tmax를 조정할 수 있다. Tmax 자동화로 얻은 표 데이터는 간편한 비교를 위해 내보내거나 RapidDSC의 Tmax 시각화 및 오버레이 탭에서 확인할 수 있다.
RapidDSC를 사용하여 자동으로 감지한 Tmax와 비교하기 위해 NanoAnalyze Software의 수동 분석을 수행했다. 자동화된 피크 감지 기능과 수동으로 비교하기 위해 각 스캔은 활성 셀 용량 내 단백질 몰수를 이용하여 몰 열용량으로 정규화했다. 4차 또는 5차 다항식을 정규화된 데이터의 기준선으로 적용했다. Tmax를 시각적으로 추정하여 각 전이마다 자동화된 Tmax 출력값과 비교했다. 열영상에 대한 추가 분석은 “NanoDSC: 기준선과 모델을 선택할 때 고려해야 할 사항“에 설명된 대로 모델을 피팅하여 완료할 수 있다[5]. 항체 안정성 분석에는 Voigt 모델을 권장한다.
결과 및 논의
제형 완충액 스크리닝
열 안정성은 생물학적 제제의 중요한 품질 특성이다. DSC는 용액 환경이 단백질 안정성에 미치는 영향의 특성을 밝히는 데 사용되는 기본적인 도구이다. 단백질 안정성은 pH, 완충액 유형, 이온 강도, 부형제 및 계면활성제와 같은 다양한 변수의 영향을 받는다. 이러한 영향은 Tmax의 작은 변화 또는 최대 수십 도의 큰 변화로 관찰될 수 있다[6]. 생물약제 업계의 니즈에 부응하기 위해 설계된 TA Instruments RS-DSC의 병렬 처리 방식은 생물학적 제제 단백질 약물의 용액 조건 스크리닝을 용이하게 하여,
기존 미세 열량 측정 방식에 비해 단축된 결정 시간을 제공한다.
제형 스크리닝 데이터가 완충액 성분 선정에 미치는 영향을 입증하기 위해 흔히 사용되는 4가지 완충액 조건에서 항체 허셉틴 트라스투주맙의 3회 반복 데이터를 분석했다(그림 2 및 표 1). 본 연구에서는 다양한 제형 완충액에 준비한 항체를 약 20 mg/mL에서 스크리닝했다. 그러나 TA Instruments의 RS-DSC는 최대 330 mg/mL 이상의 제형 강도 단백질 농도를 처리할 수 있도록 특별히 설계되어 희석하지 않은 의약품의 열 안정성 테스트가 가능하다. 추가 정보는 TA Instruments의 애플리케이션 노트인 “고농도 생물학적 제제의 신속한 열 안정성 스크리닝“에 나와 있다[7].
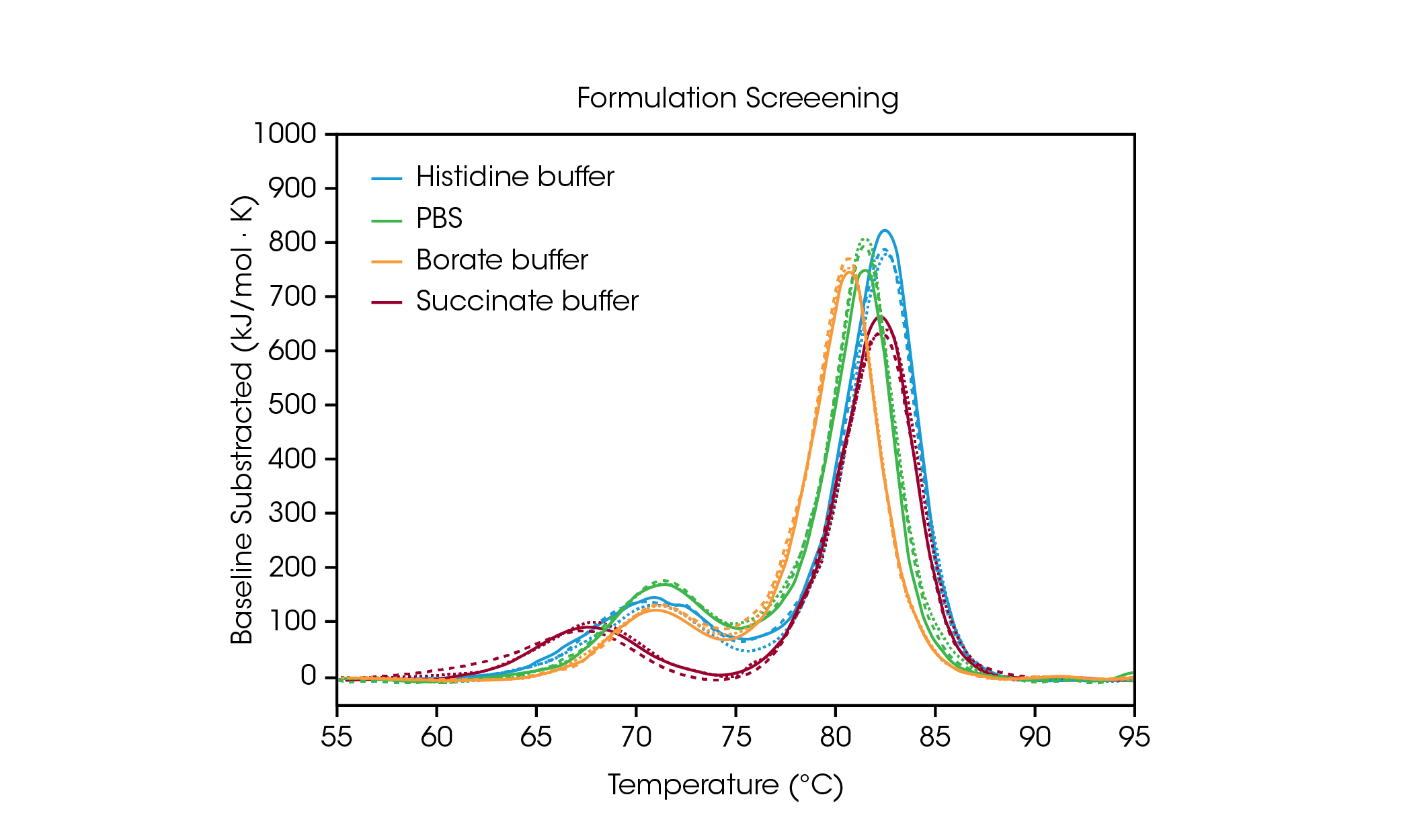
표 1. 제형 스크리닝의 전이 온도. 평균 ± SD, n = 3.
| 완충액 | Tmax,1(°C) | Tmax,2(°C) |
|---|---|---|
| 히스티딘 | 70.76 ± 0.38 | 82.66 ± 0.09 |
| 붕산염 | 70.84 ± 0.08 | 80.69 ± 0.02 |
| PBS | 71.12 ± 0.06 | 81.48 ± 0.02 |
| 숙신산 | 67.71 ± 0.22 | 82.66 ± 0.08 |
CH2 도메인의 풀림에 해당하는 첫 번째 풀림 이벤트는 히스티딘, 붕산염 또는 PBS 완충액의 영향은 크게 받지 않는다[8]. 그러나 숙신산 완충액은 CH2 도메인을 불안정하게 하여, 풀림 시작 개시 및 Tmax,1를 약 3 °C 가량 낮추게 된다. Fab 및 CH3 풀림 이벤트를 반영하는 주요 전이에 관해서는 히스티딘 및 숙신산 완충액이 가장 안정적으로 Tmax,2는 82.66 °C이다. 주요 전이의 경우 붕산염 완충액이 80.69 °C의 Tmax,2로 가장 불안정하다. 당연한 결과이지만, 본 샘플 세트에서 트라스투주맙에 대한 가장 안정적인 완충액은 승인된 의약품의 최종 제형에 사용되는 히스티딘 완충액이다.
제형 스크리닝 데이터 분석을 용이하기 위해, NanoAnalyze Software의 자동화된 Tmax 감지를 사용하면 최대 3개의 전이를 정확하게 감지할 수 있다. 피크 선택 알고리즘의 정확성을 입증하기 위해 히스티딘 완충액 내 50 mg/mL의 트라스투주맙에 대한 자동 Tmax,1 및 Tmax,2를 수동 피크 선택과 비교하여 그림 2 및 표 3에 요약했다. 자동 분석의 경우 관심 온도 범위를 지정할 필요가 없는 자동 개시 후크 감지 기능을 사용해 4차 기준선 다항식을 적용한 후 2개의 피크가 감지되었다.
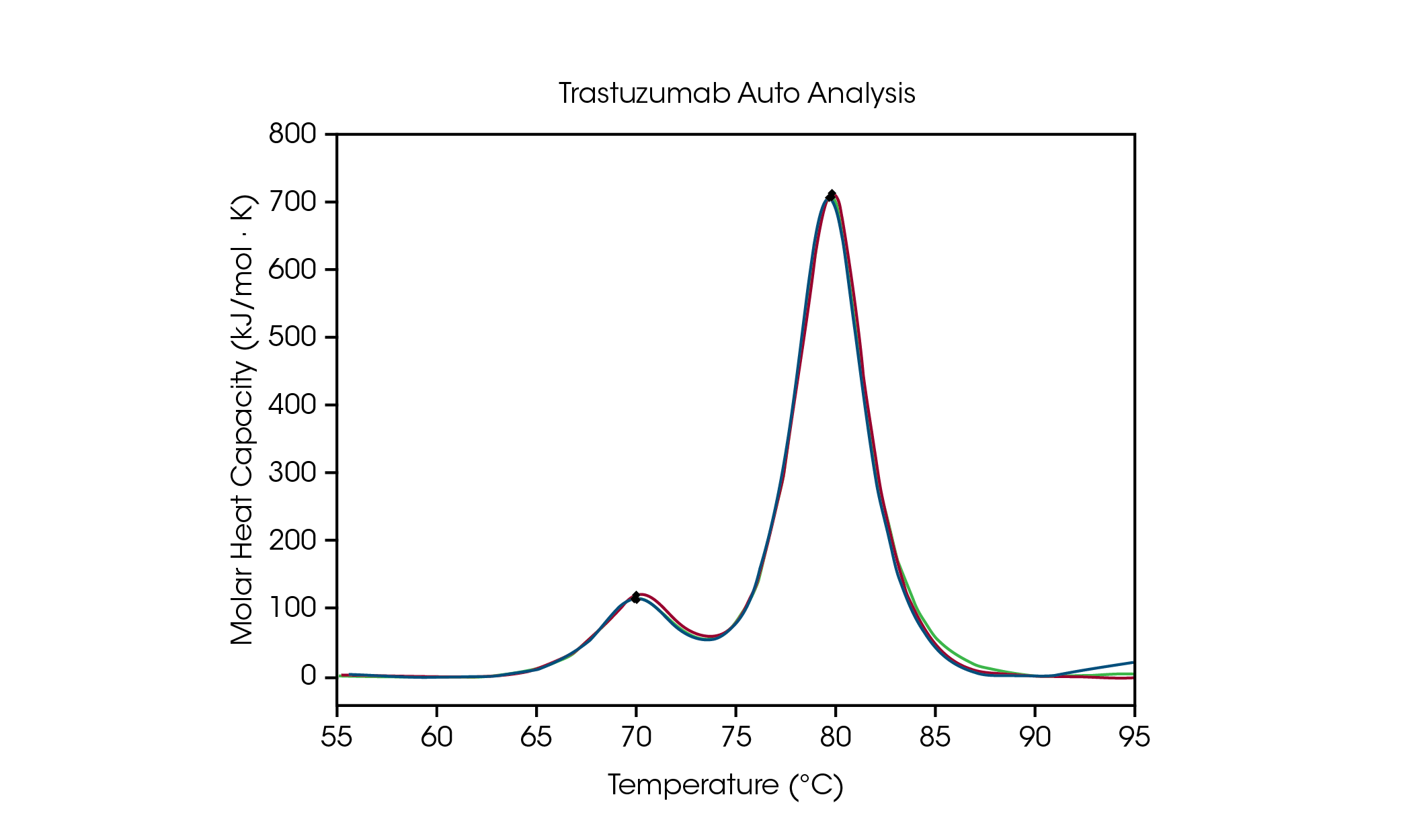
표 2. 트라스투주맙에 대한 자동 및 수동 Tmax 감지 비교.
| 샘플 | 자동 Tmax,1(°C) | 수동 Tmax,1(°C) | 자동 Tmax,2(°C) | 수동 Tmax,2(°C) |
|---|---|---|---|---|
| 반복 실행 1 | 71.93 | 72.04 | 82.92 | 82.88 |
| 반복 실행 2 | 71.81 | 71.93 | 82.76 | 82.75 |
| 반복 실행 3 | 71.93 | 71.97 | 82.90 | 82.83 |
| 평균 | 71.89 ± 0.07 | 71.98 ± 0.06 | 82.86 ± 0.09 | 82.82 ± 0.07 |
CH2 도메인의 풀림은 자동 Tmax,1는 71.89 °C이며, 수동 피크 분석의 경우 71.98 °C이다. 주 전이의 자동 Tmax,2는 82.86 °C이며, 수동 피크 분석의 경우 82.82 °C이다. 트라스투주맙에 대한 탁월한 재현성이 관찰되었다. 3회 반복 실행했을 때 수동 및 자동 피크 분석을 모두 사용한 결과 두 피크의 Tmax 모두 기기 정확성 한계인 ± 0.2 °C 이내에 있는 것이 관찰되었다. 데이터를 완전히 이해하기 위해 항상 육안 검사를 수행하는 것이 권장된다. 이 데이터 세트는 자동화된 DSC 분석 기능이 다중 전이 열영상에서 정확하게 Tmax를 감지할 수 있음을 입증한다.
서열 변형 스크리닝
단백질 돌연변이는 단백질 구조와 기능의 최적화를 위한 흔한 전략으로, 단일 아미노산의 변경도 전반적인 단백질 안정성에 측정 가능한 영향을 미칠 수 있다. DSC는 단백질의 열 안정성에 대한 돌연변이의 영향을 알아보는 데 사용되며 생물학적 제제 개발 파이프라인에서 의사 결정을 내리는 데 도움을 줄 수 있다. 아미노산 서열의 변형이 풀림에 미치는 영향의 유형을 입증하기 위해, 단백질 서열 내 단일 아미노산 돌연변이로 인한 열 안정성의 변화에 관한 소규모 패널 조작 항체를 스크리닝했다(그림 4 및 표 3).
모 항체에서 CH2, Fab, CH3 도메인의 풀림 현상은 Tmax 75.92 °C의 주요 열 전이 하나에 포함되어 있다. 모 단백질로부터 Tmax 75.52 °C의 단기 열 안정성에 큰 영향을 미치지 않는 단일 아미노산 돌연변이(돌연변이 1)를 제작했다. 그러나 추가로 생겨난 단일 아미노산 돌연변이는 단백질의 안정성에 상당한 영향을 미치는 것으로 나타났다(돌연변이 2 및 돌연변이 3). 돌연변이 2에서 명확한 숄더가 관찰되는데, 이는 Tmax,2가 75.14 °C인 모 단백질과 비교할 때 70.04 °C의 Tmax,1이 추가된 CH2 도메인의 불안정성 및 주 전이의 작은 변화로 인한 것일 수 있다. 돌연변이 3은 CH2 도메인의 큰 불안정성을 유발하여 Tmax,1가 64.85 °C인 추가 풀림 피크를 생성한다. 주 전이는 75.29 °C의 Tmax,2에 상대적으로 영향을 받지 않는다. 돌연변이 3의 상당한 불안정화에서 볼 수 있듯이, 변형이 항상 동일한 영향을 미치는 것은 아니며 오히려 변형 부위와 새로운 아미노산의 물리화학적 특성에 따라 달라진다. 단백질의 구조적 안정성을 통해 아미노산 서열 변형의 원하는 기능상 이점을 최적화하면 구조와 기능 간 관계를 이해하는 데 도움이 되며, 첨단 치료제 개발을 촉진할 수 있다.
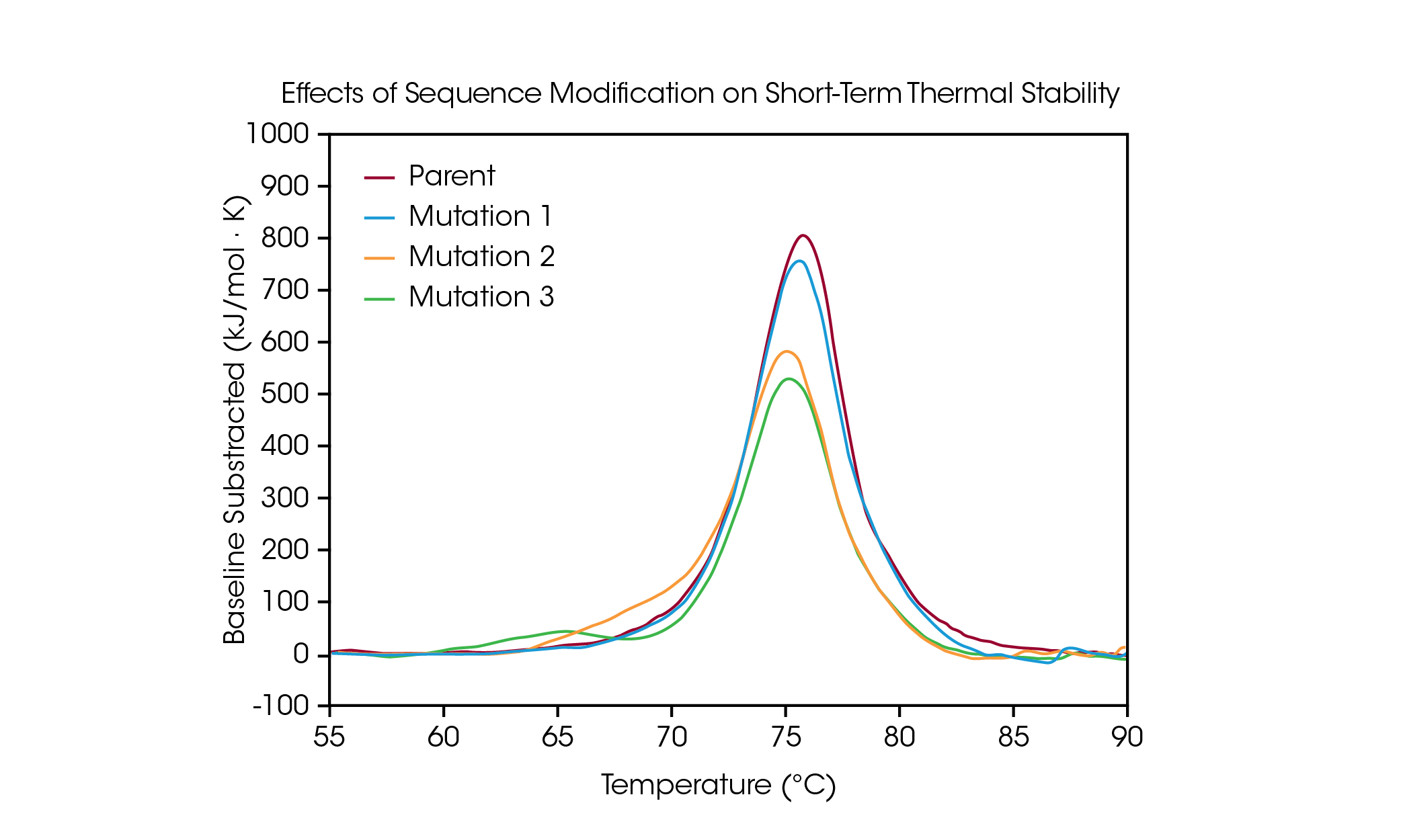
표 3. 돌연변이 스크리닝의 전이 온도. 평균 ± SD, n = 3. *Voigt 모델로 결정.
| 샘플 | Tmax,1(°C) | Tmax,2(°C) |
|---|---|---|
| 모 단백질 | — | 75.92 ± 0.15 |
| 돌연변이 1 | — | 75.52 ± 0.14 |
| 돌연변이 2 | 70.04 ± 0.86* | 75.14 ± 0.06 |
| 돌연변이 3 | 64.85 ± 0.05* | 75.29 ± 0.06 |
결론
용액 환경 및 서열 변형이 단기 열 안정성에 미치는 영향을 스크리닝하는 것은 고품질 의약품 개발에 있어 대단히 중요하다. TA Instruments RS-DSC를 이용하면 최대 24개의 샘플을 동시에 분석하여 높은 처리량의 열 안정성 테스트를 수행할 수 있어 결정까지의 시간을 현저히 개선할 수 있다. 여기에서는 복잡한 다중 전이 항체 샘플의 정확하고 재현성 있는 분석과 완충액 구성 성분 및 돌연변이의 신속한 결정이 단백질의 전체 구조에 미치는 영향을 입증했다. 이제 데이터 처리 소프트웨어인 NanoAnalyze의 새로운 알고리즘을 이용하여 높은 처리량의 스크리닝을 통해 대량으로 손쉽게 열 분석을 실시할 수 있다. 종합적으로 TA Instruments의 RS-DSC는 열응력에 대한 회복력, 제품 품질을 파악하고 규제 승인을 지원하는 데 중요한 변수인 항체 의약품의 안정성 특성 규명을 위한 새로운 플랫폼을 제공한다.
참고 문헌
- V. T. Oi, T. M. Vuong, R. Hardy, J. Reidler, J. Dangl, L. A. Herzenberg and L. Stryer, “Correlation between segmental flexibility and effector function of antibodies,” Nature, vol. 307, pp. 136-140, 1984.
- P. L. Privalov and S. A. Potekhin, “Scanning microcalorimetry in studying temperature-induced changes in proteins,” Methods in Enzymology, vol. 131, pp. 5-51, 1986.
- J. Wen, Y. Jiang and L. Nahri, “Effect of Carbohydrate on Thermal Stability of Antibodies,” American Pharmaceutical Review, vol. 11, p. 98, 2008.
- “Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters,” ASTM E2603-15, 2023.
- “NanoDSC: 기준선과 모델을 선택할 때 고려해야 할 사항” TA Instruments, MC154.
- C. M. Johnson, “Differential scanning calorimetry as a tool for protein folding and stability,” Archives of Biochemistry and Biophysics, vol. 531, pp. 100-109, 2013.
- “고농도 생물학적 제제의 신속한 열 안정성 스크리닝” TA Instruments, MC177.
- K. J. Arlotta, A. V. Gandhi, H.-N. Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, “In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution,” Antibodies, vol. 7, p. 6, 2018.
여기를 클릭하여 이 애플리케이션 노트의 인쇄용 버전을 다운로드해 주십시오.

