關鍵字:差示掃描量熱法, 差示掃描量熱儀, 單株抗體 (mAb), 抗體藥物產品, 短期熱穩定性, 高通量, 配方開發
MC178-TW
摘要
短期熱穩定性測試對於確保產品品質和支持抗體藥物產品的監管審批至關重要。 TA Instruments™ RS-DSC(快速篩選差示掃描量熱儀) 可對緩衝液配方和蛋白質序列修飾進行熱穩定性篩選。該儀器提供了一個平台,可同時分析多達 24 種配方濃度的樣本。本應用說明提供的數據說明了 TA Instruments RS-DSC 在緩衝液短期熱穩定性篩選,和抗體藥物產品開發中蛋白質修飾分析方面的實用性。
引言
了解抗體的結構-功能關係為理解功能變異是如何產生的基礎,無論是由於溶液條件的改變,還是序列修飾所致。抗體結構特性分析是確定這些差異的重要一步。此外,評估生物分子在不同熱條件下的穩定性,對於確保這些藥物產品的品質和監管審批至關重要。
差示掃描量熱法 (DSC) 是一種熱技術,用於理解抗體結構及評估化合物對熱應力的抗性。短期熱穩定性是評估抗體藥物產品的一個關鍵品質屬性。它是候選原料選定和預配置過程中使用的一個關鍵指標,也是在臨床製劑開發過程中選擇緩衝液成分(包括賦形劑、緩衝鹽類、去污劑和 pH 值)的一個重要參數。由於這種篩選的性質,通常需要運行和分析數十到數百個樣本。傳統 DSC 研究速度緩慢,一次只能測試一個樣品,並且需要在樣品之間進行仔細的清潔,才能獲得最佳結果。TA Instruments RS-DSC 是一種用於高通量熱穩定測試的新平台,可同時分析 24 個樣本,重新定義了熱穩定性測試格局。透過熱分析,能提供快速且全面的物理化學洞見,可降低新藥上市的成本和時間。
抗體的 DSC 熱像圖具有顯著的多樣性。有些抗體只顯示一個峰值,而有些抗體則展示多個不同峰值,或體現為更大展開波峰上之肩峰的重疊峰值。有人認為,這些熱像圖的變化與蛋白質結構鉸鏈區的靈活性相關。 [1]。對多結構域蛋白質的研究表明,這些複雜和重疊的峰值可能是結構域間相互作用的結果 [2]。先進的 DSC 研究甚至成功地確定了抗體重鏈部分內個別結構域的展開溫度[3]。這些研究的終極目標是確定熱穩定性,因為穩定性差會嚴重影響溶解度,導致聚集情況的發生,這是一種在生物治療中的常見問題。

實驗與方法
Herceptin™ Trastuzumab 是按照包裝說明在組胺酸配置緩衝液 (18.4 mg/mL 海藻糖二水合物、0.08 mg/mL 聚山梨醇酯 20、0.49 mg/mL 組胺酸鹽酸鹽、0.32 mg/mL 組胺酸,pH 6.0) 於 21 mg/mL 濃度下配置的,並於使用前儲存於 4 °C 的溫度下。為了在不同的緩衝液進行分析,抗體將使用 Amicon™ Ultra 10kDa 分子量截留離心式旋轉過濾器進行緩衝液交換。
硼酸鹽緩衝液由 50 mM 硼酸、50 mM 氯化鈉 和 pH 值為 8.0 的 2 mM EDTA 組成。PBS 緩衝液為一種常見的工作用緩衝液,是由 Gibco™ DPBS 和 pH 值為 7.4 的 1 mM EDTA 組成。用於 KADCYLA™ 琥珀酸配方緩衝液是一種建立在 trastuzumab 抗體架構上的抗體藥物複合物,由 10 mM 琥珀酸鈉和 pH 值為 5.0 的 6% w/v 蔗糖組成。
用於突變篩選的抗體樣本是由 Cell Signaling Technology 設計和提供的,並在濃度為 20 mg/mL 的 PBS 緩衝液 (pH 7.4) 中進行分析。
用移液器將蛋白質樣本直接吸入一次性玻璃微流體晶片 (MFC) 中,該晶片設計有可容納 11 μL 液體樣本的通道。加入蛋白質溶液後,微流體晶片將用帶有黏著劑的玻璃蓋玻片密封,於加熱至 100 °C 過程中容納樣本。將組裝好的 MFC 放到 TA Instruments RS-DSC 中每個雙卡計的樣本側(圖 1)。參考側留有一個可重複使用的聚醚醚酮 (PEEK) 晶片。最多可同時運作 24 個樣本,溫度範圍為 20 – 100 °C,預設掃描速率為 1 或 2 °C/分鐘。 由於無需在掃描之間進行清潔,因此在一個典型工作日內最多可運行 96 個樣本。
使用 RS-DSCRun 軟體操作的 TA Instruments RS-DSC,設定為在每次掃描開始前 1800 秒達到初始溫度平衡。每個樣本皆會重複測試三次,並在整個溫度範圍(20 至 100 °C)內,以 1 或 2 °C/分鐘的速度進行掃描。
為了確保所有 24 個量熱計的準確性,首先使用二棕櫚酰磷脂酰膽鹼 (DPPC) 對儀器進行校準和驗證,可接受的 Tmax 與預期文獻值的偏差小於 0.2 °C。[4]
數據資料將使用 NanoAnalyze™ 軟體 (v4.0.0) 進行處理。NanoAnalyze 軟體的新功能可自動檢測變性中點溫度 (Tmax) ,並對多達 96 個熱像圖進行比較。NanoAnalyze 軟體 v4.0.0 包括一種新的軟體演算法,RapidDSC,可透過搜尋指定數據範圍內的峰值來自動檢測 DSC 熱像圖中的 Tmax。自動基準線被應用於整個峰值,並用於精確調整 Tmax 溫度,以提高準確性。自動峰值檢測功能最多可在相關溫度範圍內顯示三個峰值。自動化功能可在彈出「基準線和 Tmax 編輯器」視窗中輕鬆編輯,縮小檢測視窗,選擇特定範圍進行峰值識別,或調整自動化基準線和 Tmax。來自 Tmax 自動化的表格數據可以匯出,便於輕鬆進行比較,或者在 RapidDSC 的 Tmax 視覺化和覆蓋分頁中查看。
在 NanoAnalyze 軟體中進行手動分析,可與使用 RapidDSC 檢測到的自動化 Tmax 進行比較。欲與自動化峰值檢測功能進行比較,使用活性細胞體積中的蛋白質莫爾數,將每個掃描值標準化為摩爾熱容量。將四次或五次多項式作為基準線應用於數據標準化上。透過目測估計 Tmax ,並與每次轉換的自動化 Tmax 輸出進行比較。如《NanoDSC:選擇基準線和模型時的注意事項 》所述,可透過模型擬合完成對熱像圖的進一步分析 [5]。在分析抗體穩定性時,建議使用 Voigt 模型。
結果與討論
製劑配方緩衝液篩選
熱穩定性是生物藥物產品的一大關鍵品質屬性。DSC 是分析溶液環境特性對蛋白質穩定性影響的主要工具。蛋白質的穩定性受溶液環境中一系列變數的影響,如 pH 值、緩衝液類型、離子強度、賦型劑和洗滌劑。這些影響可能以 Tmax 的微小變化表現,也可能以高達數十度的較大變化表現[6]。TA Instruments RS-DSC 的平行通量設計,考慮到生物製藥產業的需求,有助於生物蛋白藥物溶液條件的篩選,相較於
傳統微量熱法,可縮短決策時間。
為了說明製劑配方篩選數據如何幫助選擇緩衝液成分,我們分析了在四種常見緩衝液條件下,來自抗體 Herceptin Trastuzumab 的三份重複數據(圖 2 和表 1)。在這項研究中,對不同製劑緩衝液中 ~ 20 mg/mL 的抗體進行篩選;然而,TA Instruments RS-DSC 的獨特設計,可以處理濃度高達 330+ mg/mL 的製劑配方強度蛋白質,進而對未稀釋的藥物產品進行熱穩定性測試。欲知更多資訊,請參閱 TA Instruments 的應用說明「高濃度生物藥物的快速熱穩定性篩選」[7]。
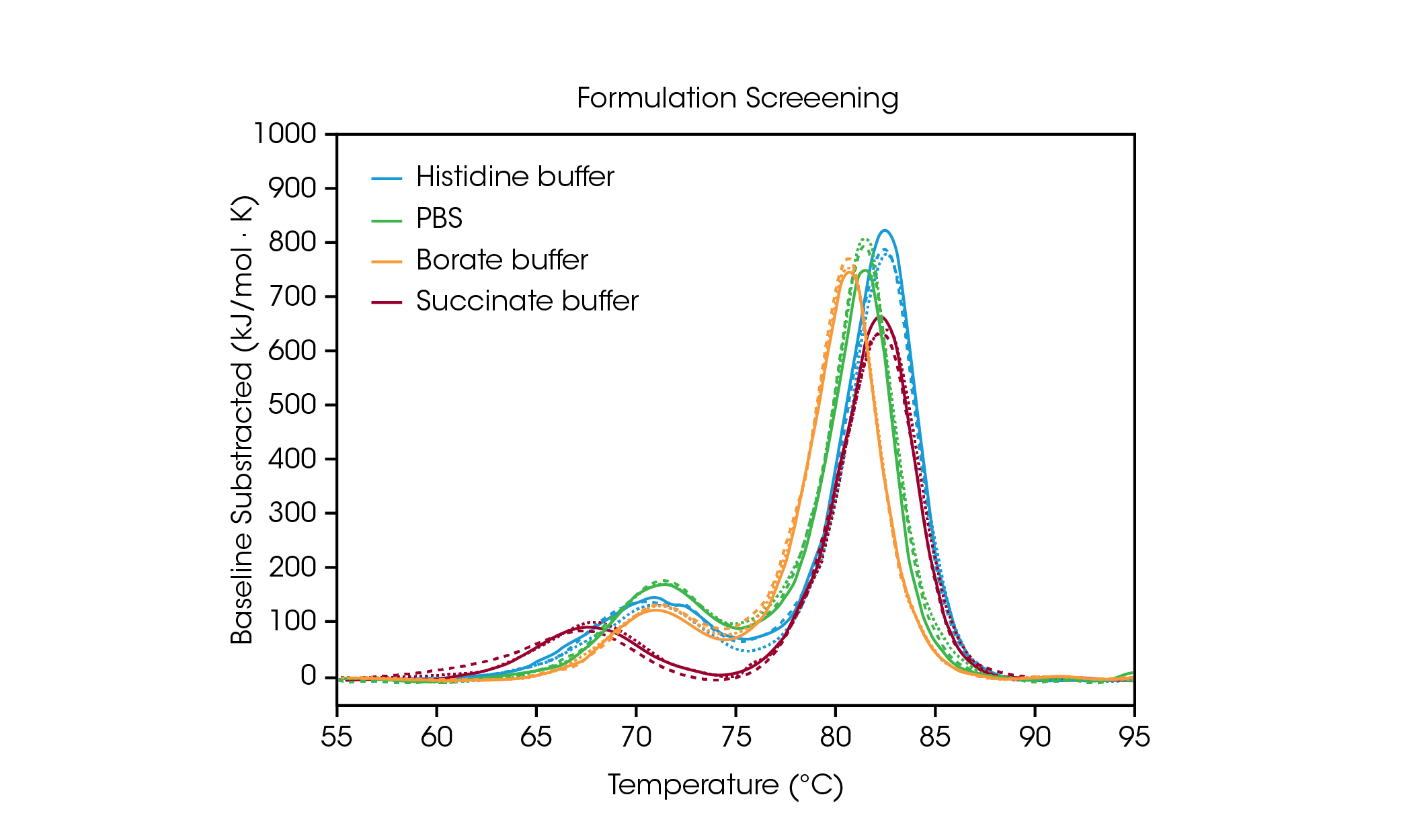
表 1. 製劑配方篩選的轉換溫度。平均值 ± 標準差,n = 3。
| 緩衝液 | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 組胺酸 | 70.76 ± 0.38 | 82.66 ± 0.09 |
| 硼酸鹽 | 70.84 ± 0.08 | 80.69 ± 0.02 |
| PBS 緩衝液 | 71.12 ± 0.06 | 81.48 ± 0.02 |
| 琥珀酸鹽 | 67.71 ± 0.22 | 82.66 ± 0.08 |
組胺酸、硼酸鹽或 PBS 緩衝液對與 CH2 結構域展開相關的第一個展開事件的影響不大 [8]。然而,琥珀酸緩衝液會使 CH2 結構域不穩定,導致其展開的起始溫度和 Tmax,1 下降約 3°C。在反映 Fab 和 CH3 結構展開事件的主要轉換方面,組胺酸和琥珀酸鹽緩衝液的穩定性最好,Tmax,2 為 82.66°C。主要轉換在硼酸鹽緩衝液中最不穩定,Tmax,2 為 80.69°C。不出所料,此樣本組中 trastuzumab 最穩定的緩衝液製劑配方是用於核准藥物產品最終配方的組胺酸緩衝液。
為便於製劑配方篩選的數據分析,NanoAnalyze 軟體中的自動 Tmax 檢測功能,可在蛋白質穩定性篩選中準確檢測多達三個轉換溫度。為了證明峰值擷取演算法的準確性,將組胺酸製劑配方緩衝液中,濃度 50 mg/mL trastuzumab 的自動 Tmax,1 and Tmax,2 ,與手動擷取峰值進行比較,見圖 3 和表 2。在自動分析中,在應用四次基準多項式後,檢測到兩個峰值, 且將使用自動啟動掛鉤檢測功能,該功能不需要指定感興趣的溫度範圍。
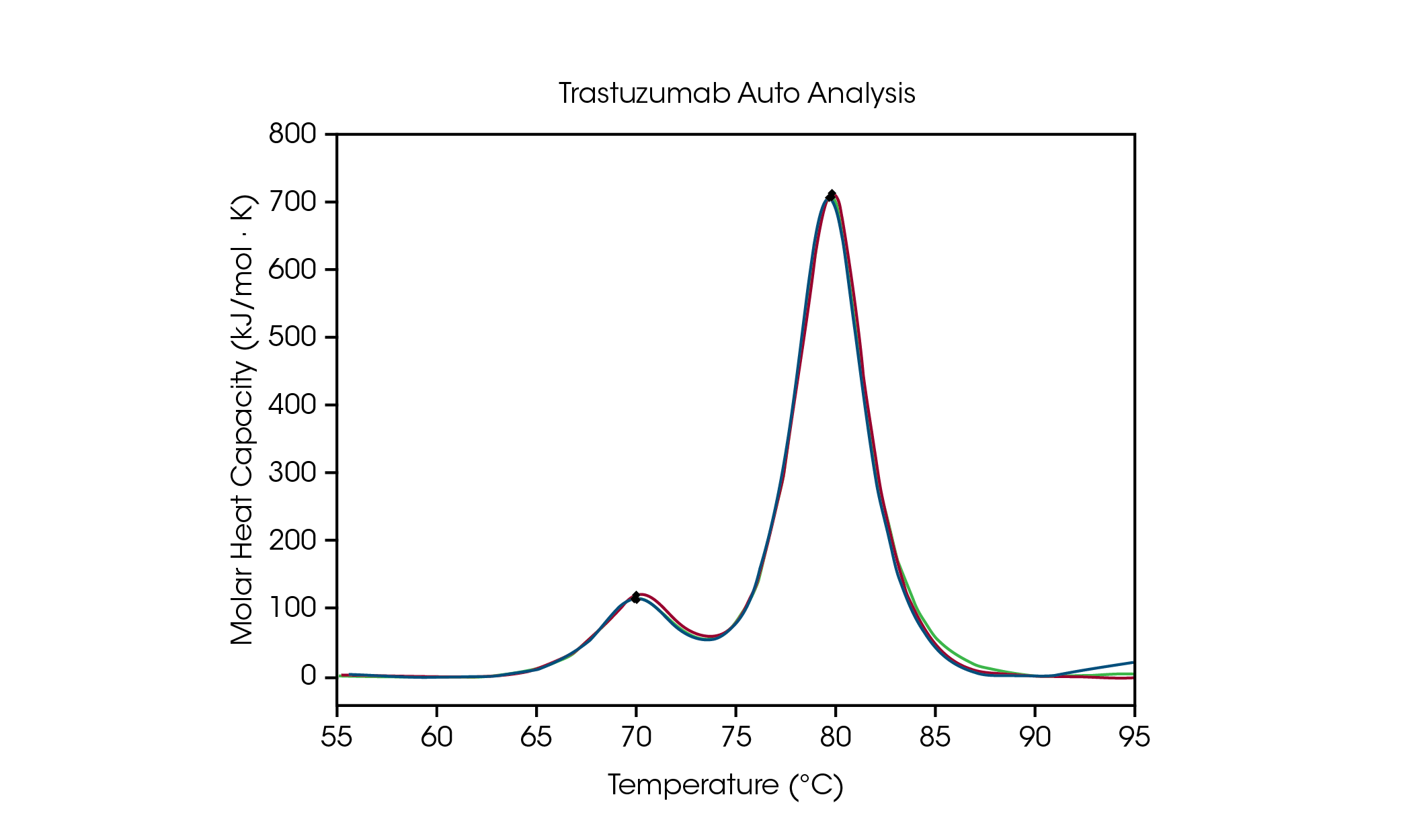
表 2. trastuzumab 自動和手動的 Tmax 檢測比較。
| 樣本 | 自動 Tmax,1 (°C) | 手動 Tmax,1 (°C) | 自動 Tmax,2 (°C) | 手動 Tmax,2 (°C) |
|---|---|---|---|---|
| 重複數據 1 | 71.93 | 72.04 | 82.92 | 82.88 |
| 重複數據 2 | 71.81 | 71.93 | 82.76 | 82.75 |
| 重複數據 3 | 71.93 | 71.97 | 82.90 | 82.83 |
| 平均值 | 71.89 ± 0.07 | 71.98 ± 0.06 | 82.86 ± 0.09 | 82.82 ± 0.07 |
CH2 結構域展開的自動 Tmax,1 為 71.89 °C,而手動峰值分析值則為 71.98 °C。主要轉換的自動 Tmax,2 為 82.86 °C,而手動峰值分析值則為 82.82 °C。 據觀察,trastuzumab 的再現性極佳。在這三個重複樣本測試中,透過手動和自動峰值分析,可以觀察到兩峰值 Tmax 皆在儀器準確度 ± 0.2 °C 的範圍內。建議進行目視檢測,確保對數據有全面的理解。這數據集表明,自動 DSC 分析功能可在多轉變熱像圖中準確檢測出 Tmax。
序列修飾篩選
蛋白質突變是最佳化蛋白質結構和功能的常見策略,即使是單一胺基酸修飾也會對蛋白質的整體穩定性產生顯著影響。DSC 可用於了解突變對蛋白質熱穩定性的影響,有助於指引生物藥物開發過程中的決策。為了證明序列修飾對穩定性的影響類型,我們篩選了一小部分人工改造蛋白質,以檢測蛋白質序列中,單一胺基酸突變引發的熱展開變化。 (圖 4 和表 3)。
在母體抗體中,CH2、Fab 和 CH3 結構域的展開包含在一個 Tmax 為 75.92 °C 的主要熱轉換過程中。從母體蛋白中產生了單一胺基酸突變,該突變對 Tmax為 75.52 °C 的短期熱穩定性(突變 1)不會造成重大影響。 然而,額外的單一氨基酸突變(突變 2 和突變 3)對蛋白質的穩定性有重大影響。在突變2 中觀察到一個明顯的肩峰,這可能與 CH2 結構域的不穩定性有關,其 Tmax,1增加到 70.04 °C,同時與母體蛋白相比,主要轉變發生了小幅移動,Tmax,2 為75.14 °C。突變 3 嚴重破壞了 CH2 結構域的穩定性,導致出現一個完全額外的展開峰值,其 Tmax,1 為 64.85 °C。主要轉變相對不受影響,Tmax,2 為 75.29 °C。正如突變 3 中所示明顯的不穩定化,修飾並不一定具有相同的效果,而是取決於修飾的位置和新胺基酸的物理化學性質。透過蛋白質的結構穩定性來最佳化序列修飾的所需功能優勢,有助於理解結構與功能之間的關係,並促進先進療法的發展。
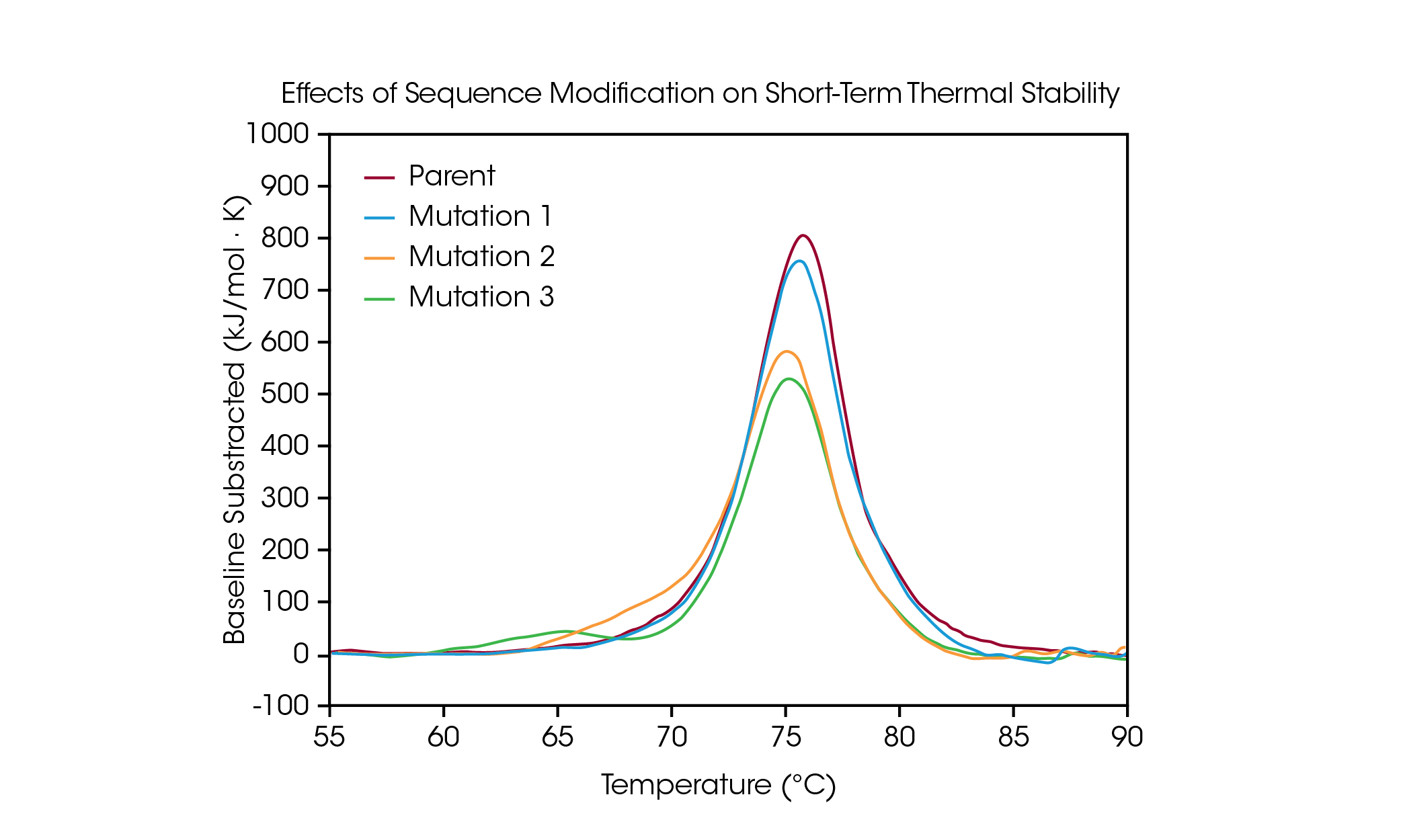
表 3. 突變篩選的轉換溫度。平均值 ± 標準差,n = 3。*透過 Voigt 模型確認。
| 樣本 | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 母體 | — | 75.92 ± 0.15 |
| 突變 1 | — | 75.52 ± 0.14 |
| 突變 2 | 70.04 ± 0.86* | 75.14 ± 0.06 |
| 突變 3 | 64.85 ± 0.05* | 75.29 ± 0.06 |
結論
篩選溶液環境和序列修飾對短期熱穩定性的影響對於開發高品質的藥物產品至關重要。TA Instruments RS-DSC 透過同時測試多達 24 個樣品來實現熱穩定性的高通量篩選,大大縮短了決策時間。在此,我們展示對複雜的多重轉換抗體樣本進行準確、可重複的分析,以及快速確定緩衝液成分和突變對整體蛋白質結構造成的影響。數據資料處理軟體 NanoAnalyze 中的新演算法,有助於透過高通量篩選,對獲得的大量熱數據進行分析。總之,TA Instruments RS-DSC 提供了一個用於表徵抗體藥物產品穩定性的新平台,這是了解熱應力恢復能力、產品品質和支援監管審批的重要變數。
參考資料
- V.T. Oi, T. M. Vuong, R. Hardy, J. Reidler, J. Dangl, L. A. Herzenberg and L. Stryer, “Correlation between segmental flexibility and effector function of antibodies,” Nature, vol. 307, pp. 136-140, 1984.
- P.L. Privalov and S. A. Potekhin, “Scanning microcalorimetry in studying temperature-induced changes in proteins,” Methods in Enzymology, vol. 131, pp. 5-51, 1986.
- J.Wen, Y. Jiang and L. Nahri, “Effect of Carbohydrate on Thermal Stability of Antibodies,” American Pharmaceutical Review, vol. 11, p. 98, 2008.
- “Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters,” ASTM E2603-15, 2023.
- “NanoDSC: What to Consider when Choosing a Baseline and Model,” TA Instruments, MC154.
- C.M. Johnson, “Differential scanning calorimetry as a tool for protein folding and stability,” Archives of Biochemistry and Biophysics, vol. 531, pp. 100-109, 2013.
- “Rapid Thermal Stability Screening of High Concentration Biologic Drugs,” TA Instruments, MC177.
- K.J. Arlotta, A. V. Gandhi, H.-N.Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, “In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution,” Antibodies, vol. 7, p. 6, 2018.
請按此處下載本應用說明的可列印版本。

