Stichwörter: Dynamische Differenzkalorimetrie, Hochdurchsatz-Screening der Thermostabilität, kurzzeitige Thermostabilität
MC177-DE
Abstract
Prüfungen der Thermostabilität von Biopharmazeutika sind zur Sicherstellung der Produktqualität und mit Blick auf die behördliche Zulassung von biologischen Arzneimitteln von entscheidender Bedeutung. Der TA Instruments™ RS-DSC (Rapid Screening-Differential Scanning Calorimeter) stellt eine Plattform für die gleichzeitige Analyse von bis zu 24 Proben dar. Darüber hinaus können hohe Konzentrationen von Protein-Arzneimittelkandidaten mithilfe von mikrofluidischen Einwegchips mit niedrigem Volumen geprüft werden. In diesem Anwendungshinweis werden Daten zur Nachweisgrenze und zum Konzentrationsbereich für die Analyse mit dynamischer Differenzkalorimetrie (Differential Scanning Calorimetry, DSC) zur Veranschaulichung der Verwendung des RS-DSC von TA Instruments vorgestellt.
Einleitung
Prüfungen der kurzzeitigen Thermostabilität sind für die Beurteilung der Beständigkeit einer Verbindung gegenüber thermischer Belastung und damit für die Vorhersage der Haltbarkeit und die Aufrechterhaltung der Wirksamkeit von zentraler Bedeutung. Die dynamische Differenzkalorimetrie ist eine Technik, die zur Überprüfung der Antikörperstruktur eingesetzt wird. Allerdings sind Proben in Formulierungskonzentration mit herkömmlichen Geräten schwer zu charakterisieren. Diese Schwierigkeiten ergeben sich aus der Verwendung einer nicht austauschbaren Probenzelle, was langwierige Reinigungsschritte erfordert, um eine Probenverschleppung zwischen den Scans zu verhindern. Die feste Probenzelle schränkt zudem den oberen Konzentrationsbereich ein, da hochkonzentriertes Protein beim Erhitzen die Zelle verstopfen kann. Im besten Fall muss eine verstopfte Zelle zur Regeneration aufwändig und aggressiv gereinigt werden. Im schlimmsten Fall kann die Zelle irreversibel verunreinigt sein. Daher müssen Proben in Formulierungskonzentration verdünnt werden. Die Konzentration von Proteinen kann sich auf die Thermostabilität auswirken. Daher erfordert ein genaues Verständnis der Proteinstabilität potenzieller Arzneimittel unter Lagerbedingungen die Prüfung von Proben in Formulierungsstärke.
Der RS-DSC von TA Instruments ist eine innovative Weiterentwicklung der dynamischen Differenzkalorimetrie im Mikrobereich. Im Gegensatz zu anderen dynamischen Differenzkalorimetern fordert der RS-DSC von TA Instruments keine Probenverdünnung, da er speziell für die Analyse hochkonzentrierter biologischer Arzneimittelformulierungen in mikrofluidischen Einwegchips mit geringem Volumen ausgelegt ist. Diese Technologie macht eine wiederholte Reinigung der Messzelle des Instruments zwischen den Analysen überflüssig, was Zeit spart, das Kontaminationsrisiko verringert und zuverlässigere Messwerte ermöglicht. Eine Probe kann in weniger als einer Minute vorbereitet, verschlossen und zur Analyse bereitgestellt werden, sodass für eine präzise Beurteilung bereits kleinste Mengen ausreichen. Der RS-DSC von TA Instruments – eine völlig neu konzipierte Plattform für Prüfungen der Thermostabilität mit hohem Durchsatz für die biopharmazeutische Industrie – ermöglicht die gleichzeitige Analyse von 24 Proben. Die umfangreichen physikalisch-chemischen Informationen aus der thermischen Analyse können die Entwicklung von Arzneimitteln und gegebenenfalls ihre Zulassung effizient beschleunigen.

Experimente und Methoden
Es wurde unter Einhaltung der Packungsanleitung eine Zubereitung von Herceptin™ Trastuzumab in Histidin-Formulierungspuffer (18,4 mg/ml Trehalose-Dihydrat, 0,08 mg/ml Polysorbat 20, 0,49 mg/ml Histidin-HCl, 0,32 mg/ml Histidin, pH 6,0) mit 21 mg/ml hergestellt und bis zur Verwendung bei 4 °C aufbewahrt. Für die Analyse in phosphatgepufferter Salzlösung wurde unter Verwendung eines Amicon™ Ultra-Zentrifugenfilters mit 10 kDa Molekulargewichtsausschluss ein Pufferaustausch des Antikörpers in phosphatgepufferter Salzlösung bestehend aus Gibco™ DPBS mit 1 mM EDTA bei pH 7,4 durchgeführt. Anschließend wurde der Antikörper auf die gewünschte Konzentration eingestellt und in Dreifachproben getestet.
Das zur Bewertung hochkonzentrierter Proteinlösungen verwendete Hühnereiweiß-Lysozym stammte von Sigma Aldrich (L6876) und war in Glycinpuffer (0,1 M Glycin, pH 2,5) formuliert. Proteinproben wurden unter Verwendung eines Amicon™ Ultra-Zentrifugenfilters mit 3 kDa Molekulargewichtsausschluss auf 330 mg/ml eingeengt. Aus der konzentrierten Lösung wurden Verdünnungen hergestellt. Die Experimente wurden mit dem RS-DSC von TA Instruments mit Dreifachproben unmittelbar nach der Herstellung der Proteinkonzentrationen durchgeführt.
Die Proteinprobe wird direkt in die Einweg-Mikrofluidikchips (microfluidic chips, MFCs) aus Glas pipettiert, deren Kanal 11 μl flüssige Probe aufnehmen kann. Nach Zugabe der Proteinlösung werden die Einweg-Mikrofluidikchips mit selbstklebenden Glasdeckgläsern verschlossen, um ein Verdunsten der Probe während des Erhitzens auf 100 °C zu vermeiden, und können dann direkt in den RS-DSC von TA Instruments eingesetzt werden (Abb. 1). Die fertigen Einweg-Mikrofluidikchips werden auf der Probenseite jedes der beiden Kalorimeter platziert. Ein wiederverwendbarer Polyetheretherketon-Chip befindet sich auf der Referenzseite. Es können bis zu 24 Proben gleichzeitig in einem maximalen Temperaturbereich von 20 °C bis 100 °C und mit voreingestellten Scanraten von 1 °C/min oder 2 °C/min analysiert werden. Da die Reinigung zwischen den Scans entfällt, können an einem typischen Arbeitstag bis zu 96 Proben gemessen werden.
Der RS-DSC von TA Instruments wurde mit der Software RS-DSCRun von TA Instruments verwendet und konnte sich vor Beginn jedes Scans 1800 s lang auf die Anfangstemperatur äquilibrieren. Jede Probe wurde dreimal gemessen und mit 1 °C/min oder 2 °C/min über den gesamten Temperaturbereich (20 °C bis 100 °C) gescannt.
Zur Sicherstellung der Genauigkeit aller 24 Kalorimeter wurde das Gerät zunächst mit Dipalmitoylphosphatidylcholin (DPPC) kalibriert und validiert (akzeptable Tmax-Verschiebung von jeweils weniger als 0,2 °C vom erwarteten Literaturwert) [1].
Die Datenverarbeitung erfolgte mit der Software NanoAnalyze™ (v4.0.0). Neue Softwarefunktionen ermöglichen die automatische Erkennung des mittleren Punkts der Denaturierungstemperatur (Tmax) und den Vergleich von bis zu 96 Thermogrammen. Die Software NanoAnalyze v4.0.0 enthält einen neuen Softwarealgorithmus, RapidDSC, der Tmax in Thermogrammen von dynamischen Differenzkalorimetern automatisch erkennt, indem er im angegebenen Datenbereich nach Peaks sucht. Auf den Peak wird eine automatische Grundlinie angewendet und zur Verbesserung der Genauigkeit bei der Bestimmung der Tmax-Temperatur verwendet. Automatische Peakerkennungsfunktionen zeigen bis zu drei Peaks im relevanten Temperaturbereich an. Die Automatisierungsfunktionen lassen sich im Popup-Fenster „Baseline and Tmax Editor“ einfach verändern, um das Erkennungsfenster einzugrenzen, einen spezifischen Bereich für die Peakidentifizierung auszuwählen oder die automatisierte Grundlinie und Tmax anzupassen. Die Daten aus der Tmax-Automatisierung können zu Vergleichszwecken als Tabelle exportiert oder in den Registerkarten in RapidDSC zur Anzeige und Überlagerung der Tmax-Daten dargestellt werden.
Ergebnisse und Diskussion
Nachweisgrenze des RS-DSC von TA Instruments
Wenn lediglich geringe Probenmengen erforderlich sind, ist es wichtig, die Konzentrationsgrenzen zu kennen, die erforderlich sind, um sensitive und präzise Daten zu erhalten. Schnellere Scanraten führen zu einer höheren Signalintensität und können bei der Analyse von Proteinkonzentrationen an oder nahe der Nachweisgrenze hilfreich sein. Zur Feststellung der Anforderung an die Konzentration eines Proteins mit mehreren Übergängen wurde der Antikörper Herceptin Trastuzumab auf unterschiedliche Konzentrationen in phosphatgepufferte Salzlösung eingestellt und in Dreifachproben bei einer Scanrate von 2 °C/min gemessen (Abb. 2 und Tabelle 1).
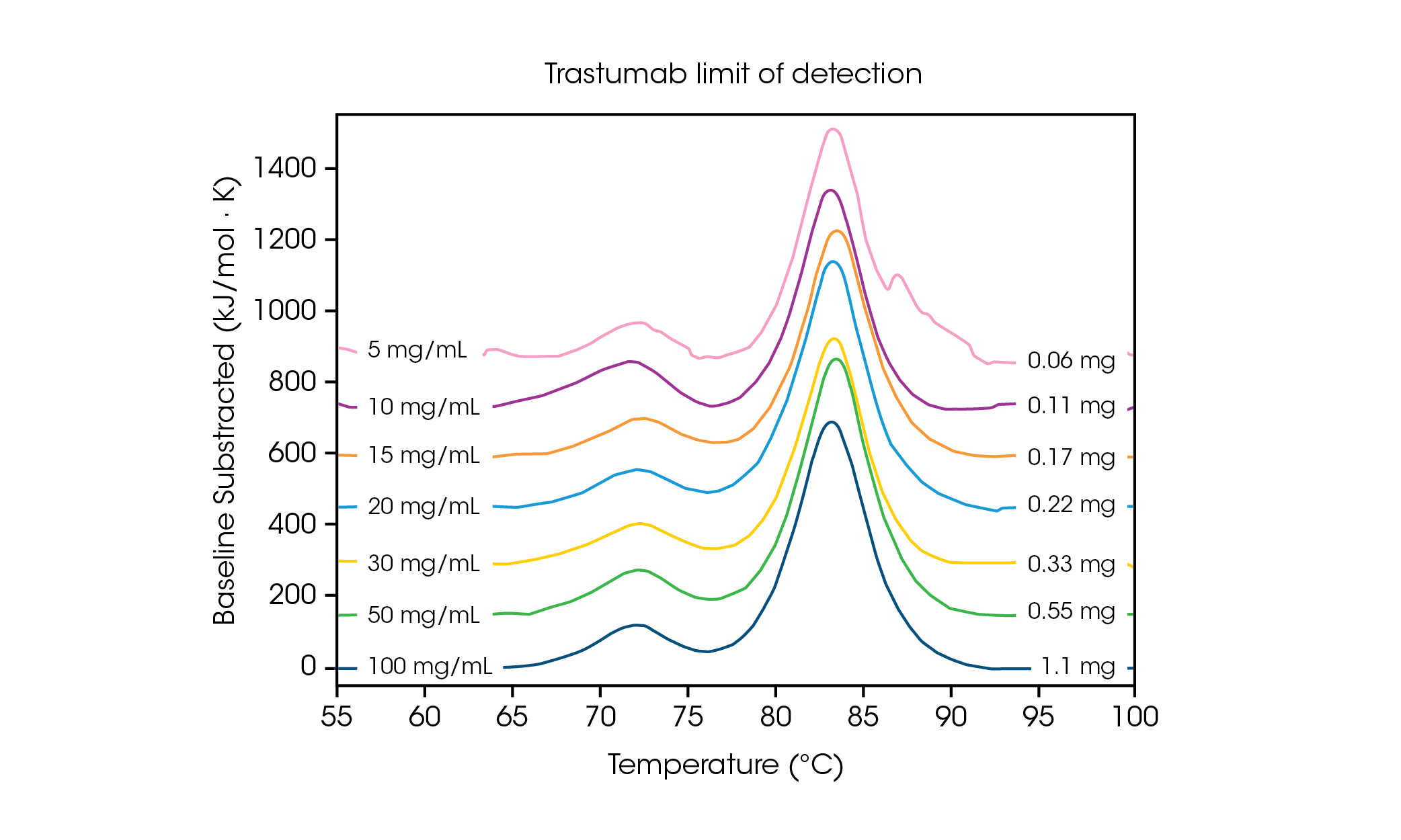
Tabelle 1. Übergangstemperaturen und Screening der Reproduzierbarkeit über die Nachweisgrenze hinweg Mittelwert ± SD, n = 3.
| Konz. | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 5 mg/ml | 72,57 ± 0,52 | 83,06 ± 0,09 |
| 10 mg/ml | 71,83 ± 0,29 | 82,98 ± 0,05 |
| 15 mg/ml | 72,13 ± 0,23 | 83,17 ± 0,11 |
| 20 mg/ml | 71,88 ± 0,01 | 82,99 ± 0,08 |
| 30 mg/ml | 71,91 ± 0,12 | 83,10 ± 0,03 |
| 50 mg/ml | 71,93 ± 0,08 | 83,20 ± 0,02 |
| 100 mg/ml | 71,85 ± 0,01 | 83,01 ± 0,01 |
Bei einer Konzentration von 100 mg/ml sind zwei Übergänge erkennbar, die mit der Auffaltung der Domäne CH2 bei einer durchschnittlichen Tmax,1 von 71,85 °C und der kombinierten Domänen Fab und CH3 bei einer durchschnittlichen Tmax,2 von 83,01 °C korrelieren[2]. Es liegt keine signifikante Änderung der Stabilität vor, wenn die Proteinkonzentration sinkt, bei hervorragender Reproduzierbarkeit im Vergleich der einzelnen Kalorimeter. Bei 20 mg/ml Herceptin Trastuzumab ist die Größenordnung des CH2-Auffaltungsübergangs deutlich verringert, es liegt jedoch eine hervorragende Reproduzierbarkeit bei Betrachtung der Dreifachproben vor (Abb. 3). Unter 20 mg/ml wird die Analyse der kleineren, sich auffaltenden Domäne CH2 schwieriger und die detektierte Tmax,1 weist eine stärkere Variabilität auf. Größere Auffaltungsereignisse wie die kombinierten Domänen Fab- und CH3 (Tmax,2) werden selbst bei Konzentrationen von nur 5 mg/ml leichter erkannt. Wie bei allen Geräten zur dynamischen Differenzkalorimetrie sind schärfere, schmalere Peaks am besten reproduzierbar. Die Nachweisgrenze hängt von der Probe ab und kann je nach Komplexität des Proteins und der Lösungsumgebung variieren.
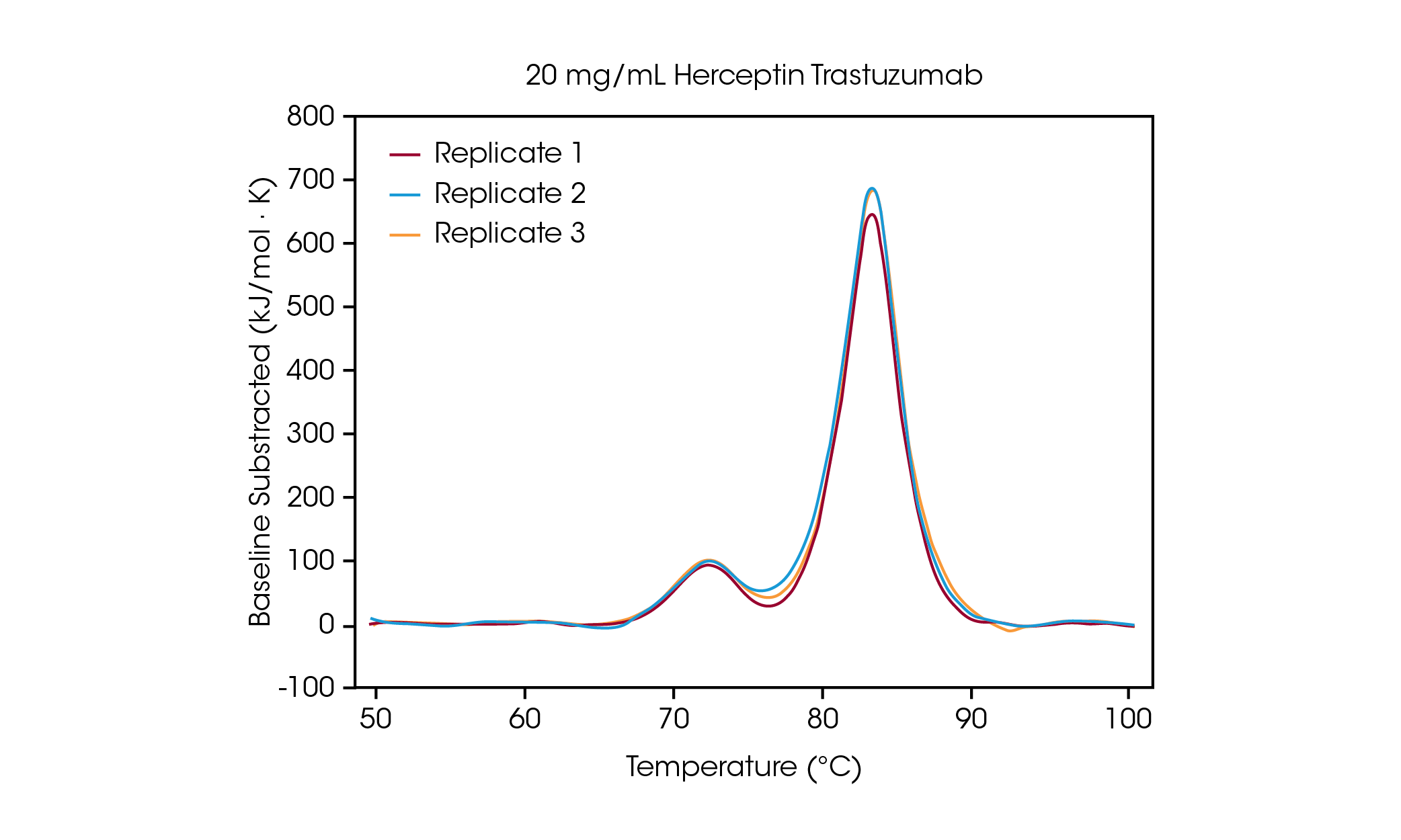
Untersuchung der Konzentrationsabhängigkeit der Thermostabilität
Der RS-DSC von TA Instruments ist speziell für die Analyse hochkonzentrierter biologischer Arzneistoffproben konzipiert, insbesondere von Antikörper-Arzneistoffen und Antikörper-Wirkstoff-Konjugaten. Bedingt durch den zunehmend erfolgreichen Einsatz von Antikörpertherapeutika herrscht in der Pharmaindustrie Interesse an hochkonzentrierten Dosierungsformen, die eine subkutane und okulare Arzneimittelabgabe ermöglichen. Daher sind Konzentrationen von 50 mg/ml bis 150 mg/ml Antikörper nicht ungewöhnlich, teilweise sogar mit einem Gehalt von 200 mg/ml und mehr [3]. Die Formulierung von Proteinen in hohen Konzentrationen kann die Anfälligkeit für physikalische Instabilität erhöhen [4, 5]. Umgekehrt haben einige Fallstudien eine Verbesserung der Thermostabilität bei erhöhten Konzentrationen gezeigt [6]. Daher ist das Verständnis der thermisch bedingten Auffaltung und der Reaktion auf die Lösungsumgebung bei der jeweiligen Formulierungskonzentration eine entscheidende Messgröße für die Minderung der Arzneimittelhaftung.
Der RS-DSC von TA Instruments ist für die Aufnahme von Proteinproben in mikrofluidischen Einwegchips konzipiert. Herkömmliche mikrokalorimetrische Instrumente enthalten eine feste Probenzelle, die zwischen den Experimenten gereinigt werden muss. Hochkonzentrierte Proben, die während des Auffaltungsprozesses zur Ausfällung oder Gelierung neigen, können im besten Fall schwierig zu entfernen sein oder im schlimmsten Fall die Zelle beschädigen. Die im RS-DSC von TA Instruments verwendeten Einweg-Mikrofluidikchips sind nicht nur benutzerfreundlicher und machen zeitaufwändige Reinigungsprotokolle überflüssig, sondern ermöglichen auch die risikofreie Prüfung hochkonzentrierter Proteinproben.
Zur Veranschaulichung der Prüfung hochkonzentrierter Proteinproben und der Bedeutung einer solchen Prüfung bei der gewünschten Formulierungskonzentration wurde Hühnereiweiß-Lysozym von 30 mg/ml bis 330 mg/ml in Glycinpuffer analysiert (Abb. 4 und Tabelle 2). Aufgrund seines einfachen Thermogramms mit nur einem Übergang bei niedrigen Konzentrationen (~1 mg/ml) wird Lysozym häufig als Referenztestprobe in der dynamischen Differenzkalorimetrie verwendet. Durch die Analyse von Proteinkonzentrationen, die bis zu 100-fach höher waren, wurde eine Konzentrationsabhängigkeit der Lysozymstabilität festgestellt.
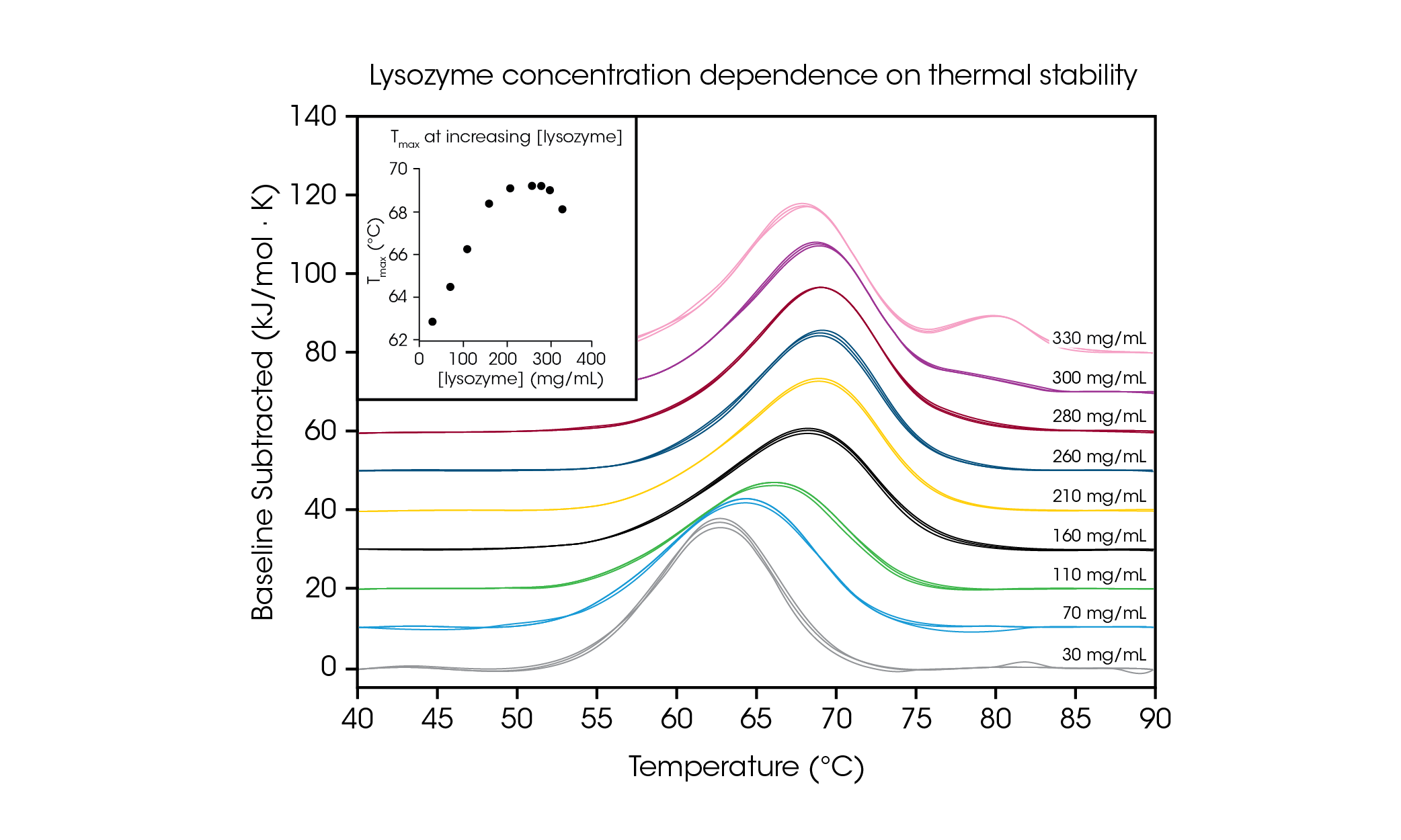
Tabelle 2. Übergangstemperaturen und Reproduzierbarkeit bei der Prüfung der Konzentrationsabhängigkeit mit Lysozym Mittelwert ± SD, n = 3.
| Konz. | Tmax (°C) |
|---|---|
| 330 mg/ml | 68,14 ± 0,05 |
| 300 mg/ml | 69,00 ± 0,04 |
| 280 mg/ml | 69,22 ± 0,04 |
| 260 mg/ml | 69,19 ± 0,09 |
| 210 mg/ml | 69,08 ± 0,06 |
| 160 mg/ml | 68,39 ± 0,04 |
| 110 mg/ml | 66,27 ± 0,09 |
| 70 mg/ml | 64,68 ± 0,05 |
| 30 mg/ml | 62,81 ± 0,06 |
Bei der niedrigsten getesteten Konzentration, 30 mg/ml, betrug die gemessene Tmax von Lysozym 62,81 °C. Bei einer Konzentration von 160 mg/ml Anstieg erhöhte sich die Stabilität linear (siehe Einschub in Abb. 4) bis zu einer Tmax von 68,39 °C. Von 210 mg/ml bis 280 mg/ml erreichte die Thermostabilität ein Plateau bei einer Tmax von ~ 69,2 °C. Interessanterweise liegt bei einer Konzentration von 300 mg/ml ab etwa 80 °C eine Schulter am Ende des Hauptübergangs vor und die Gesamtstabilität des Hauptübergangs nimmt mit einer Tmax von 69,00 °C leicht ab. Bei der höchsten Konzentration von 330 mg/ml sinkt die Thermostabilität des Hauptübergangs Tmax,1 weiter auf 68,14 °C und es ist ein zusätzlicher Peak mit einer Tmax,2 von 80,28 ± 0,04 °C zu sehen. Mit der Möglichkeit zur Prüfung hoher Konzentrationen ermöglicht der RS-DSC von TA Instruments die Beobachtung der Bildung von Strukturen höherer Ordnung bei Lysozymkonzentrationen von mehr als ~300 mg/ml. Diese Studie demonstriert nicht nur, dass es möglich ist, qualitativ hochwertige Daten bei hohen Proteinkonzentrationen zu erhalten, sondern zeigt auch, wie wichtig es ist, biologische Arzneimittelprodukte bei der relevanten Konzentration zu prüfen, da eine Verdünnung die beobachtete Stabilität des Proteins verändern kann.
Fazit
Die herkömmliche Technologie der dynamischen Differenzkalorimetrie mit Einzelproben ist hochgenau, erfordert jedoch große Probenmengen und ist zeitaufwändig, was bei der Arzneimittelentwicklung eher von Nachteil sein kann. Der RS-DSC von TA Instruments ermöglicht ein Screening der Thermostabilität mit höherem Durchsatz durch gleichzeitiges Testen von bis zu 24 Proben. Ein einfacherer Arbeitsablauf, eine höhere Datenerfassungsrate durch parallele Prüfungen und eine schnellere Analyse durch automatisierte Peakerkennungsalgorithmen beschleunigen das Ergebnis erheblich. Hier demonstrieren wir eine genaue reproduzierbare Analyse von Proben eines komplexen Antikörpers mit mehreren Übergängen bis zu 20 mg/ml. Die schnellere Scanrate von 2 °C/min führt zu Signalen mit höherer Amplitude, was bei der Analyse von Proben an oder nahe der Nachweisgrenze hilfreich sein kann. Die Untersuchung hochkonzentrierter Lysozymlösungen bis zu 330 mg/ml zeigt eine unerwartete Konzentrationsabhängigkeit der Thermostabilität und unterstreicht die Bedeutung der Prüfung der jeweils relevanten Arzneimittelkonzentration. Insgesamt stellt der RS-DSC von TA Instruments eine neue Plattform zur Charakterisierung der Stabilität von Biotherapeutika dar – einer wichtigen Variable zum Verständnis der Widerstandsfähigkeit gegenüber thermischem Stress und der Produktqualität und als Daten für die behördliche Zulassung.
Literaturhinweise
- „Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters“, ASTM E2603-15, 2023.
- K. J. Arlotta, A. V. Gandhi, H.-N. Chen, C. S. Nervig, J. F. Carpenter und S. C. Owen, „In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution“, Antibodies, Vol. 7, S. 6, 2018.
- R. G. Strickley und W. J. Lambert, „A review of formulations of commercially available antibodies“, Journal of Pharmaceutical Sciences, Vol. 110, S. 2590-2608, 2021.
- J. Zarzar, T. Khan, M. Bhagawati, B. Weiche, J. Syndow-Andersen and S. Alavattam, „High concentration formulation developability approaches and considerations“, MAbs, Vol. 15, S. 1-13, 2023.
- S. J. Shire, Z. Shahrokh und J. Liu, „Challenges in the development of high protein concentration formulations“, Journal of Pharmaceutical Sciences, Vol. 93, S. 1390-1402, 2004.
- C. Zhang, J. W. Bye, L. H. Lui, H. Zhang, J. Hales, S. Brocchini, R. A. Curtis und P. A. Dalby, „Enhanced Thermal Stability and Reduced Aggregation in an Antibody Fab Fragment at Elevated Concentrations“, Molecular Pharmaceutics, Vol. 20, S. 2650-2661, 2023.
Hier klicken, um eine Druckversion dieses Anwendungshinweises herunterzuladen.

