Palabras clave: calorimetría diferencial de barrido, escaneo de estabilidad térmica de alto rendimiento, estabilidad térmica a corto plazo
MC177-ES
Resumen
Las pruebas de estabilidad térmica bioterapéutica son cruciales para asegurar la calidad del producto y apoyar la aprobación regulatoria de medicamentos biológicos. El RS-DSC (Calorímetro Diferencial de Barrido, de Escaneo Rápido [Rapid Screening-Differential Scanning Calorimeter]) de TA Instruments™ proporciona una plataforma para el análisis simultáneo de hasta 24 muestras. Además, se pueden evaluar concentraciones altas de candidatos a fármaco proteína al utilizar chips microfluídicos desechables de bajo volumen. Esta nota de aplicación proporciona datos que ilustran la utilidad del RS-DSC de TA Instruments al evaluar el límite de detección y demostrar el rango de concentraciones que se prestan a análisis con calorimetría diferencial de barrido (DSC).
Introducción
Las pruebas de estabilidad térmica a corto plazo son esenciales para evaluar la resistencia de un compuesto al estrés térmico, lo cual es clave para predecir la vida útil y mantener la eficacia. La calorimetría diferencial de barrido (DSC) es una técnica que se emplea para comprender la estructura de los anticuerpos; sin embargo, las muestras de concentración de formulación son difíciles de caracterizar en instrumentos tradicionales. Estos desafíos se derivan del uso de una celda de muestra irreemplazable, que requiere largos pasos de limpieza para evitar el arrastre de muestra entre escaneos. La celda de muestra fija también limita el rango de concentración superior, porque es más probable que la proteína altamente concentrada obstruya la celda al calentarse. En el mejor de los casos, una celda obstruida requiere una limpieza meticulosa y a fondo para regenerarla. En el peor de los casos, la contaminación de una celda puede ser irreversible. De este modo, las muestras requieren dilución desde sus concentraciones de formulación. La concentración puede afectar la estabilidad térmica de las proteínas, de modo que una comprensión precisa de la estabilidad de las proteínas para fármacos potenciales en condiciones de almacenamiento requiere la prueba de muestras de concentración de la formulación.
El RS-DSC de TA Instruments es un avance innovador en la tecnología microcalorimétrica diferencial de barrido. A diferencia de otros DSC, el RS-DSC de TA Instruments no requiere que las muestras se diluyan porque está diseñado exclusivamente para manejar formulaciones de fármacos biológicos de alta concentración en chips microfluídicos de bajo volumen y desechables. Esta integración tecnológica elimina la necesidad de limpieza repetitiva de la celda de medición del instrumento entre ejecuciones, lo que ahorra tiempo, disminuye el riesgo de contaminación y permite lecturas más confiables. Una muestra se puede preparar, sellar y dejar lista para el análisis en menos de un minuto, y solo se requieren volúmenes mínimos para la evaluación precisa. El RS-DSC de TA Instruments redefine el panorama de las pruebas de estabilidad térmica al analizar simultáneamente 24 muestras: una nueva plataforma para pruebas de estabilidad térmica de alto rendimiento para la industria biofarmacéutica. Proporcionar información fisicoquímica integral por medio de análisis térmico puede acelerar el desarrollo de medicamentos para llevarlos al mercado de manera eficiente.

Experimentos y métodos
Herceptin® Trastuzumab se preparó según las instrucciones del paquete en amortiguador de formulación de histidina (18.4 mg/ml de trehalosa dihidrato, 0.08 mg/ml de polisorbato 20, 0.49 mg/ml de histidina HCl, 0.32 mg/ml de histidina, pH 6.0) a 21 mg/ml y se almacenó a 4 °C hasta su uso. Para el análisis en solución salina amortiguada con fosfato (SSAF), el anticuerpo se intercambió con amortiguador al usar un filtro para centrifugado de corte de 10 kDa de peso molecular Amicon™ Ultra en SSAF compuesto de DPBS Gibco™ con EDTA 1 mM a pH de 7.4, ajustado a la concentración deseada, y probado por triplicado.
La lisozima de clara de huevo de gallina utilizada para la evaluación de soluciones de proteína de alta concentración se obtuvo de Sigma Aldrich (L6876) y se formuló en amortiguador de glicina (glicina 0.1 M, pH 2.5). Las muestras de proteína se concentraron a 330 mg/ml al utilizar un filtro para centrifugado de corte de 3 kDa de peso molecular Amicon Ultra. Se hicieron diluciones a partir de la solución concentrada. Los experimentos se realizaron por triplicado en el RS-DSC de TA Instruments inmediatamente después de la preparación de las concentraciones de proteína.
La muestra de proteína se pipetea directamente hacia los chips microfluídicos (CMF) de vidrio desechables con un canal diseñado para contener 11 μl de muestra líquida. Después de agregar la solución de proteína, los CMF se sellan con un cubreobjetos de vidrio con adhesivo en el reverso para contener la muestra durante el calentamiento a 100 °C, y están listos para colocarse en el RS-DSC de TA Instruments (Figura 1). Los CMF ensamblados se colocan en el lado de la muestra de cada calorímetro gemelo. En el lado de referencia queda un chip de polieteretercetona (PEEC) reutilizable. Se pueden analizar hasta 24 muestras simultáneamente con un rango de temperatura máximo de 20 a 100 °C y velocidades de escaneo preestablecidas de 1 o 2 °C/min. Al eliminar la necesidad de limpieza entre escaneos, se pueden procesar hasta 96 muestras en un día laboral típico.
El RS-DSC de TA Instruments, operado con el software RSDSCRun de TA Instruments, se configuró para equilibrarse a la temperatura inicial durante 1800 segundos antes del inicio de cada escaneo. Cada muestra se procesó por triplicado y se escaneó a 1 o 2 °C/min en todo el rango de temperatura (20 a 100 °C).
Para asegurar la precisión en los 24 calorímetros, el instrumento se calibró y validó primero con dipalmitoilfosfatidilcolina (DPFC), con un cambio de Tmáx aceptado para cada calorímetro de menos de 0.2 °C desde el valor en la literatura esperado[1].
Los datos se procesaron con el uso del Software NanoAnalyze™ (v4.0.0). Las nuevas funciones del software permiten la detección automatizada de la temperatura del punto medio de desnaturalización (Tmáx) y la comparación de hasta 96 termogramas. El Software NanoAnalyze v4.0.0 incluye un nuevo algoritmo de software, RapidDSC, que detectará automáticamente Tmáx en termogramas de DSC al buscar picos en el rango de datos especificado. Se aplica una basal automática en el pico y se utiliza para refinar más la temperatura Tmáx a fin de mejorar la precisión. Las funciones de detección automática de picos muestran hasta tres picos en el rango de temperatura de interés. Las funciones de automatización se pueden editar con facilidad en la ventana emergente “Editor de basal y de Tmáx” («Baseline and Tmáx Editor») para reducir la ventana de detección, seleccionar un rango específico para la identificación de picos o ajustar la basal y la Tmáx automatizadas. Los datos tabulados de la automatización de Tmáx se pueden exportar para una comparación fácil, o se pueden ver en las pestañas de visualización y superposición de Tmáx en RapidDSC.
Resultados y discusión
Límite de detección del RS-DSC de TA Instruments
Con requisitos bajos de volumen de muestra, es importante comprender los límites de concentración necesarios para la sensibilidad y exactitud de los datos. Las velocidades de escaneo más rápidas dan por resultado una intensidad aumentada de la señal, y pueden ayudar en el análisis de concentraciones de proteína en o cerca del límite de detección. Para comprender los requisitos de concentración para una proteína de transición múltiple, el anticuerpo Herceptin Trastuzumab se ajustó a concentraciones variables en SSAF y se evaluó por triplicado a una tasa de escaneo de 2 °C/min (figura 2 y tabla 1).
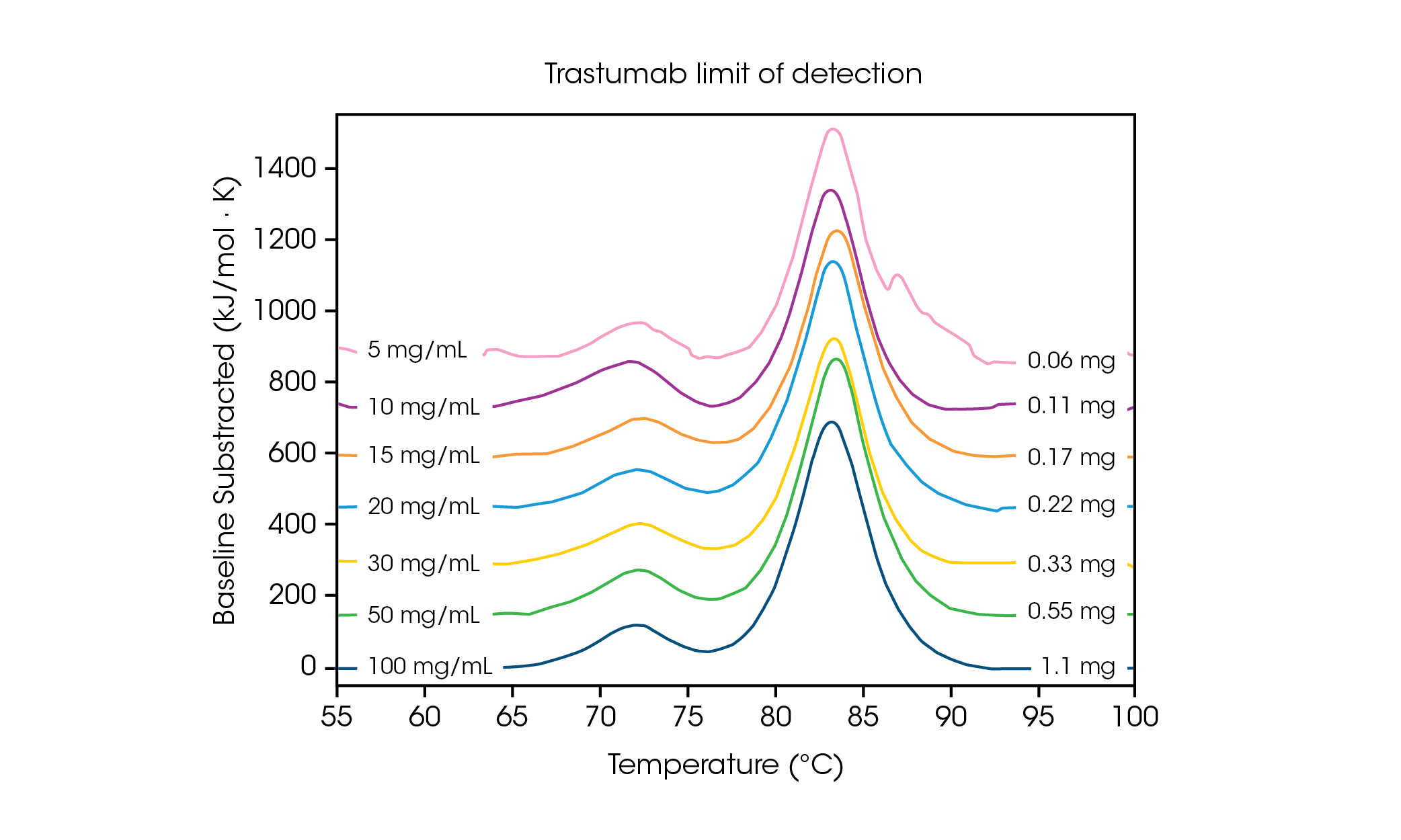
Tabla 1. Temperaturas de transición y reproducibilidad en el límite de escaneo de detección. Media ± DE, n = 3.
| Conc. | Tmáx,1 (°C) | Tmáx,2 (°C) |
|---|---|---|
| 5 mg/ml | 72.57 ± 0.52 | 83.06 ± 0.09 |
| 10 mg/ml | 71.83 ± 0.29 | 82.98 ± 0.05 |
| 15 mg/ml | 72.13 ± 0.23 | 83.17 ± 0.11 |
| 20 mg/ml | 71.88 ± 0.01 | 82.99 ± 0.08 |
| 30 mg/ml | 71.91 ± 0.12 | 83.10 ± 0.03 |
| 50 mg/ml | 71.93 ± 0.08 | 83.20 ± 0.02 |
| 100 mg/ml | 71.85 ± 0.01 | 83.01 ± 0.01 |
A una concentración de 100 mg/ml, dos transiciones son claramente visibles, y se correlacionan con el despliegue del dominio CH2 a una Tmáx,1 promedio de 71.85 °C, y los dominios Fab y CH3 combinados a una Tmáx,2 promedio de 83.01 °C [2]. A medida que la concentración de proteína disminuye no se observa cambio significativo de la estabilidad, y se observa reproducibilidad excelente entre calorímetros. A 20 mg/ml de Herceptin Trastuzumab, la magnitud de la transición de despliegue de CH2 disminuye de manera significativa; sin embargo, se observa reproducibilidad excelente en muestras por triplicado (figura 3). Por debajo de 20 mg/ml, el análisis del dominio de despliegue de CH2 más pequeño se hace más desafiante y se observa variabilidad aumentada en la Tmáx,1 detectada. Los eventos de despliegue más grandes, como los dominios Fab y CH3 combinados (Tmáx,2) se detectan con mayor facilidad, incluso a concentraciones tan bajas como 5 mg/ml. Al igual que con todos los instrumentos de DSC, los picos más agudos y estrechos proporcionan la reproducibilidad más alta. El límite de detección depende de la muestra y puede variar en función de la complejidad de la proteína y del entorno de la solución.
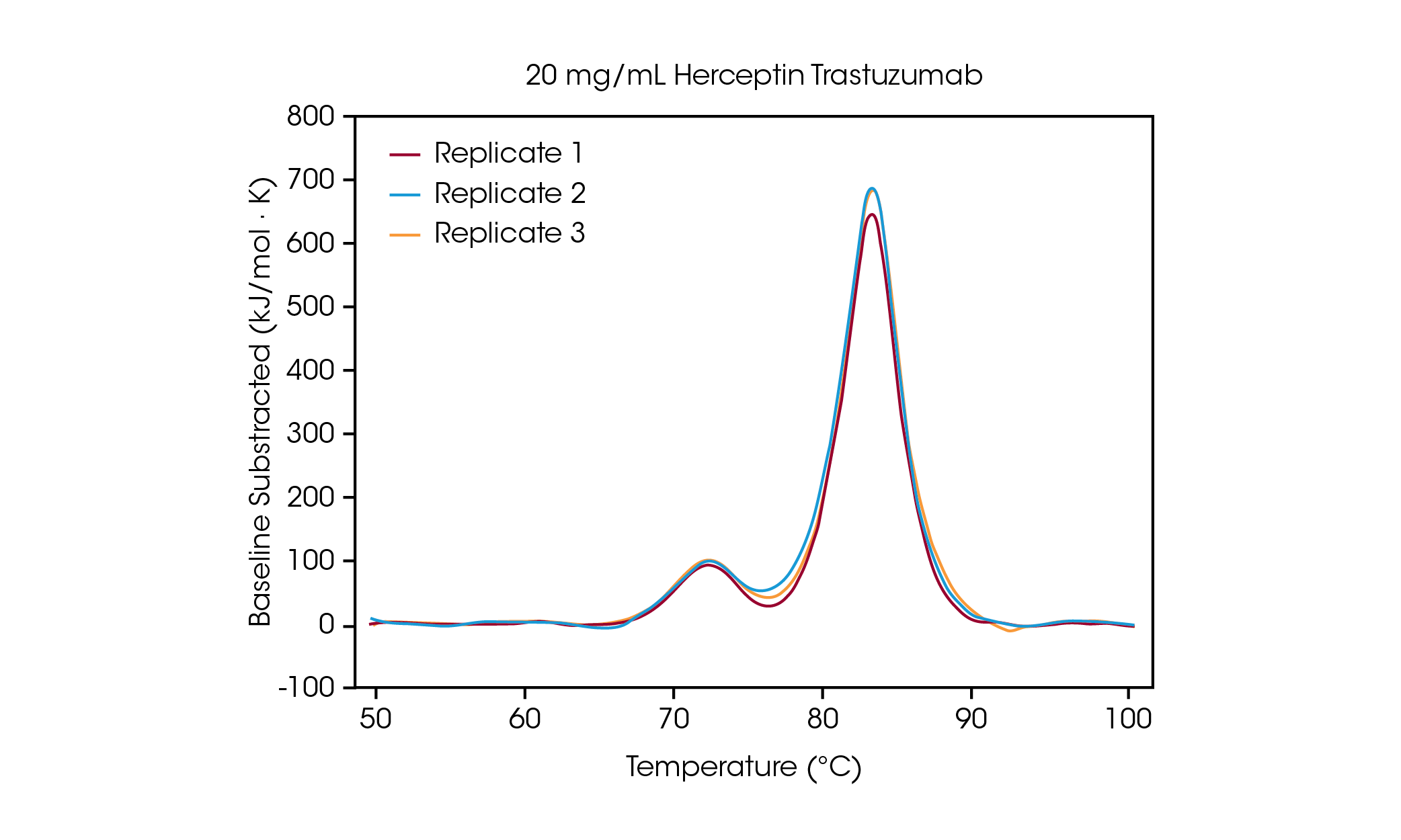
Investigación de la dependencia de la concentración de la estabilidad térmica
El RS-DSC de TA Instruments está diseñado exclusivamente para manejar muestras de fármacos biológicos de alta concentración, con un enfoque especializado en fármacos de anticuerpos y conjugados de fármacos y anticuerpos. Con el éxito creciente de la terapéutica con anticuerpos, en la industria farmacéutica hay interés aumentado en formas de dosificación de alta concentración que permitan la administración de fármacos por vía subcutánea y ocular. Por lo tanto, las concentraciones de 50 a 150 mg de anticuerpos/ml son comunes, y algunas llegan hasta más de 200 mg/ml [3]. La formulación de proteínas en altas concentraciones puede aumentar la susceptibilidad a la inestabilidad física [4, 5]. Por el contrario, en algunos casos los estudios han demostrado mejora de la estabilidad térmica a concentraciones aumentadas [6]. De este modo, la comprensión del despliegue térmico y la respuesta al ambiente de la solución a la concentración de la formulación de interés es una medida crucial para mitigar la responsabilidad por medicamentos.
El RS-DSC de TA Instruments está diseñado para contener muestras de proteína en chips microfluídicos desechables. La instrumentación microcalorimétrica tradicional contiene una celda de muestra fija que requiere limpieza entre los experimentos. Las muestras a alta concentración que son susceptibles a precipitación o gelación durante el proceso de despliegue pueden ser difíciles de limpiar en el mejor de los casos, o pueden dañar la celda en el peor de los casos. Además de mejorar la facilidad operativa y eliminar protocolos de limpieza que consumen tiempo, los chips microfluídicos desechables que se utilizan en el RS-DSC de TA Instruments permiten realizar sin riesgo pruebas de muestras de proteína a alta concentración.
Para demostrar la capacidad para probar muestras de proteína alta concentración e ilustrar la importancia de las pruebas a la concentración de formulación deseada, evaluamos lisozima de clara de huevo de gallina desde 30 hasta 330 mg/ml en amortiguador glicina (figura 4 y tabla 2). Con un termograma de transición único simple a concentraciones bajas (~1 mg/ml), la lisozima se utiliza comúnmente como una muestra de prueba de referencia para DSC. Mediante la evaluación de concentraciones de proteína hasta 100 veces más altas, observamos que la estabilidad de la lisozima tuvo dependencia de la concentración.
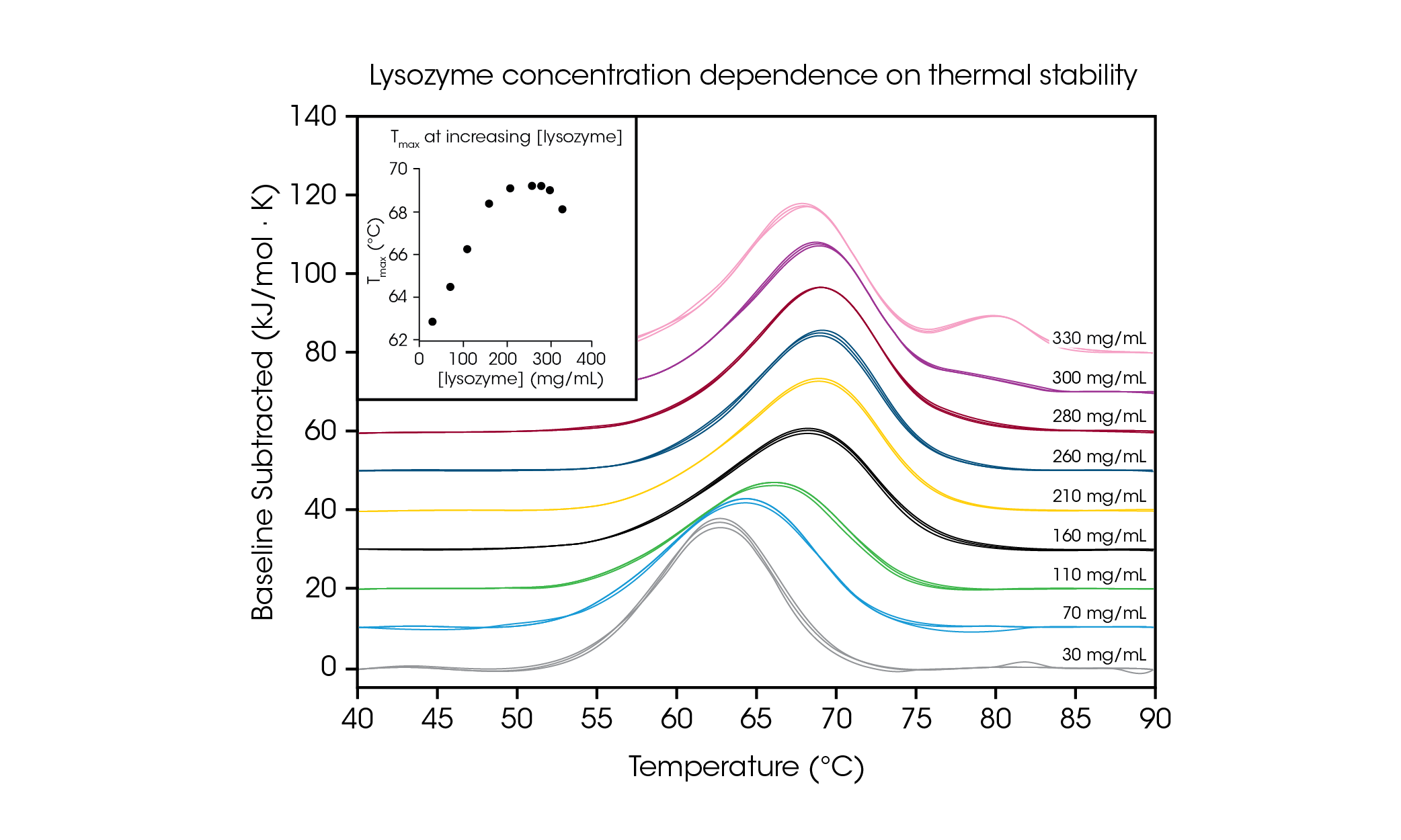
Tabla 2. Temperaturas de transición y reproducibilidad en el escaneo de dependencia de la concentración de lisozima. Media ± DE, n = 3.
| Conc. | Tmáx (°C) |
|---|---|
| 330 mg/ml | 68.14 ± 0.05 |
| 300 mg/ml | 69.00 ± 0.04 |
| 280 mg/ml | 69.22 ± 0.04 |
| 260 mg/ml | 69.19 ± 0.09 |
| 210 mg/ml | 69.08 ± 0.06 |
| 160 mg/ml | 68.39 ± 0.04 |
| 110 mg/ml | 66.27 ± 0.09 |
| 70 mg/ml | 64.68 ± 0.05 |
| 30 mg/ml | 62.81 ± 0.06 |
A la concentración más baja probada, 30 mg/ml, se midió que la Tmáx de lisozima fue de 62.81 °C. A medida que la concentración aumentó hasta 160 mg/ml, se observó un incremento lineal de la estabilidad (recuadro de la figura 4) a una Tmáx de 68.39 °C. De 210 a 280 mg/ml, la estabilidad térmica alcanzó una meseta a una Tmáx de ~ 69.2 °C. Despierta interés que a una concentración de 300 mg/ml, la presencia de un hombro en la cola de la transición principal está empezando a observarse alrededor de los 80 °C y la estabilidad general de la transición principal disminuye un poco con una Tmáx de 69.00 °C. A la concentración más alta de 330 mg/ml, la estabilidad térmica de la transición principal Tmáx,1 disminuye más hasta 68.14 °C y se observa un pico adicional con una Tmáx,2 de 80.28 ± 0.04 °C. Con la capacidad de realizar pruebas a concentración alta, el RS-DSC de TA Instruments permite la observación de la formación de estructura(s) de orden superior a concentraciones de lisozima de más de ~300 mg/ml. Además de demostrar la capacidad de adquirir datos de alta calidad a concentraciones altas de proteína, este estudio demuestra la importancia de probar medicamentos biológicos a la concentración de interés, porque la dilución puede alterar la estabilidad observada de la proteína.
Conclusiones
La tecnología de DSC de muestra única tradicional es muy precisa pero exige grandes volúmenes de muestra y puede ser una técnica que consume mucho tiempo en el proceso de desarrollo de fármacos. El RS-DSC de TA Instruments permite realizar pruebas de estabilidad térmica de más alto rendimiento por medio del análisis simultáneo de hasta 24 muestras. Un flujo de trabajo más fácil, tasa aumentada de adquisición de datos mediante pruebas paralelas, y análisis más rápido por medio de algoritmos automatizados de detección de picos disminuyen significativamente el tiempo hasta la obtención de resultados. Aquí demostramos análisis precisos y reproducibles de muestras de anticuerpos complejas-de transición múltiple hasta 20 mg/ml. La velocidad de escaneo más rápida de 2 °C/min da por resultado señales de amplitud más alta, que pueden ayudar en el análisis de muestras en el límite de detección o cerca de éste. El estudio de soluciones de lisozima a alta concentración, hasta 330 mg/ml, revela una dependencia inesperada de la concentración, de la estabilidad térmica, y pone de relieve la importancia de evaluar la concentración del producto farmacéutico de interés. En general, el RS-DSC de TA Instruments proporciona una nueva plataforma para caracterizar la estabilidad bioterapéutica — una variable importante para comprender la resiliencia al estrés térmico, la calidad del producto, y apoyar la aprobación regulatoria.
Referencias
- «Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters,» ASTM E2603-15, 2023.
- K. J. Arlotta, A. V. Gandhi, H.-N. Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, «In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution,» Antibodies, vol. 7, p. 6, 2018.
- R. G. Strickley and W. J. Lambert, «A review of formulations of commercially available antibodies,» Journal of Pharmaceutical Sciences, vol. 110, pp. 2590-2608, 2021.
- J. Zarzar, T. Khan, M. Bhagawati, B. Weiche, J. Syndow-Andersen and S. Alavattam, «High concentration formulation developability approaches and considerations,» MAbs, vol. 15, pp. 1-13, 2023.
- S. J. Shire, Z. Shahrokh and J. Liu, «Challenges in the development of high protein concentration formulations,» Journal of Pharmaceutical Sciences, vol. 93, pp. 1390-1402, 2004.
- C. Zhang, J. W. Bye, L. H. Lui, H. Zhang, J. Hales, S. Brocchini, R. A. Curtis and P. A. Dalby, «Enhanced Thermal Stability and Reduced Aggregation in an Antibody Fab Fragment at Elevated Concentrations,» Molecular Pharmaceutics, vol. 20, pp. 2650-2661, 2023.
Haga clic aquí para descargar la versión imprimible de esta nota de aplicación.

