키워드: 시차 주사 열량 측정법, 고처리량 열 안정성 스크리닝, 단기 열 안정성
MC177-KO
초록
생물약제의 열 안정성 테스트는 생물학적 제제 제품의 제품 품질을 보장하고 규제 승인을 지원하는 데 중요하다. TA Instruments™ RS-DSC(신속 스크리닝-시차 주사 열량계)는 최대 24개 샘플을 동시에 분석할 수 있는 플랫폼을 제공한다. 또한 저용량의 일회용 미세유체 칩을 이용하여 고농도 단백질 후보물질을 평가할 수 있다. 이 애플리케이션 노트에서는 검출 한계를 평가하고 시차 주사 열량계(DSC) 분석에 적합한 농도 범위를 입증하여 TA Instruments RS-DSC의 유용성을 설명하는 데이터를 제공한다.
서론
단기 열 안정성 테스트는 보관 수명 예측과 유효성 유지의 핵심인 화합물의 열응력 저항을 평가하는 데 필수적이다. 시차 주사 열량 측정법(DSC)은 항체 구조를 파악하기 위해 사용되는 기술이지만 제형 농축액 샘플은 기존 장비로 특성을 규명하기가 어렵다. 이러한 문제는 교체가 불가능한 샘플 셀 사용으로 인한 것으로, 스캔 간 샘플의 이월을 방지하기 위해 긴 세척 과정이 필요하다. 또한, 고정된 샘플 셀은 고농축 단백질 가열 시 셀이 막힐 가능성이 높기 때문에 농도 상한 범위가 제한된다. 최고의 시나리오는 전체적으로 강한 세척으로 막힌 셀을 재건하는 것이다. 최악의 경우 셀이 비가역적으로 오염될 수 있다. 따라서 샘플을 제형 농축액에서 희석해야 한다. 농도는 단백질의 열 안정성에 영향을 미칠 수 있으므로 보관 조건에서 잠재적인 약물의 단백질 안정성을 정확하게 파악하려면, 제형 강도 샘플을 테스트해야 한다.
TA Instruments의 RS-DSC는 시차 주사 미세 열량 측정 기술의 혁신적인 발전 사항이다. 다른 DSC와 달리 TA Instruments의 RS-DSC는 저용량의 일회용 미세유체 칩을 통해 고농도 생물학적 제제의 제형을 처리하는 고유한 방식으로 설계되어 샘플을 희석할 필요가 없다. 이러한 기술적 통합을 통해 실행 사이에 기기 측정 셀을 반복해서 청소할 필요가 없으므로, 시간을 절약하고 오염 위험은 줄어들며 보다 신뢰할 수 있는 측정값을 얻을 수 있다. 1분 내로 샘플을 프렙, 및봉 및 분석 준비를 완료할 수 있으므로, 정확한 평가를 위해 최소한의 용량만이 필요하다. TA Instruments RS-DSC는 24개 샘플을 동시에 분석하여 열 안정성 테스트 환경에 새로운 지평을 열었으며, 이는 생물약제 업계를 위한 고처리량 열 안정성 테스트를 위한 새로운 플랫폼이기도 하다. 열 분석을 통해 포괄적인 물리화학적 통찰력을 제공하면 약물 개발 속도를 높여 효율적인 시장 출시가 가능하다.

실험 및 방법
Herceptin® 트라스투주맙을 패키지 지침에 따라 21 mg/mL의 히스티딘 제형 완충액(트레할로스 이수화물 18.4 mg/mL, 폴리소르베이트 20 0.08 mg/mL, 히스티딘 HCl 0.49 mg/mL, 히스티딘 0.32 mg/mL, pH 6.0)에 준비한 후 사용하기 전까지 4 °C에서 보관했다. 인산완충생리식염수(PBS)에서 분석하기 위해, 항체를 Amicon™ Ultra 10kDa 분자량 컷오프 원심분리 스핀 필터를 사용하여 pH 7.4의 1 mM EDTA와 Gibco™ DPBS로 구성된 PBS 완충액으로 교환하고 원하는 농도로 조정한 후 3회 반복하여 테스트했다.
고농도 단백질 용액의 평가에 사용한 계란 흰자 라이소자임은 Sigma Aldrich(L6876)에서 구입하여 글리신 완충액(0.1 M 글리신, pH 2.5)을 이용하여 제형화했다. 단백질 샘플은 Amicon Ultra 3kDa 분자량 컷오프 원심분리 스핀 필터를 사용하여 330 mg/mL로 농축했다. 농축된 용액으로 희석액을 제조했다. 단백질 농축액을 준비한 직후 TA Instruments RS-DSC로 실험을 3회 반복하여 실시했다.
단백질 샘플을 액체 샘플 11 μL를 함유할 수 있도록 설계된 채널이 있는 일회용 유리 미세유체 칩(MFC)으로 피펫을 이용해 직접 옮긴다. 단백질 용액을 추가한 후 MFC를 100 °C까지 가열하는 동안 샘플을 함유할 수 있도록 접착력이 있는 유리 커버슬립으로 밀봉하여 TA Instruments RS-DSC에 넣을 준비를 한다(그림 1). 조립한 MFC는 각 트윈 열량계의 샘플 면에 배치한다. 재사용 가능한 폴리에텔에텔케톤(PEEK) 칩은 기준 면에 남겨 둔다. 최대 온도 범위 20~100 °C, 사전 설정 스캔 속도 1~2 °C/분을 이용하여 최대 24개 샘플을 동시에 실험할 수 있다. 스캔 사이에 세척할 필요가 없으므로, 일반적인 근무일에 최대 96개 샘플을 실행할 수 있다.
TA Instruments RSDSCRun 소프트웨어로 작동되는 TA Instruments RS-DSC는 각 스캔을 시작하기 전 1800초간 초기 온도에서 평형을 이루도록 설계되었다. 각 샘플은 전체 온도 범위(20~100 °C)에 걸쳐 1 또는 2 °C/분으로 3회 반복 스캔했다.
24개 열량계 전체의 정확성을 확보하기 위해 기기는 우선 디팔미토일포스파티딜콜린(DPPC)으로 보정 및 검증되었으며 각 열량계마다 허용된 Tmax 변동은 예상 문헌 수치에 따르면 0.2 °C 미만이었다[1].
데이터는 NanoAnalyze™ Software(v4.0.0)로 처리되었다. 새로운 소프트웨어 기능을 사용하면 변성 중간점 온도(Tmax)를 자동으로 감지하고 최대 96개 열영상을 비교할 수 있다. NanoAnalyze Software v4.0.0에는 지정된 데이터 범위에서 피크를 찾아 DSC 열영상에서 자동으로 Tmax를 감지하는 새로운 소프트웨어 알고리즘인 RapidDSC가 포함되어 있다. 피크 전체에 자동 기준선이 적용되며, 정확도를 개선하기 위해 Tmax온도를 세분화하는 데 사용된다. 자동 피크 감지 기능은 관심 온도 범위 내에서 최대 3개 피크를 표시한다. 자동화 기능은 “기준선 및 Tmax 편집기” 팝업 창에서 손쉽게 편집하여 감지 창을 좁히고, 피크 식별을 위한 특정 범위를 선택하거나 자동화된 기준선 및 Tmax를 조정할 수 있다. Tmax 자동화로 얻은 표 데이터는 간편한 비교를 위해 내보내거나 RapidDSC의 Tmax 시각화 및 오버레이 탭에서 확인할 수 있다.
결과 및 논의
TA Instruments RS-DSC의 검출 한계
필요한 샘플 양이 적으므로, 데이터의 감도 및 정확성에 필요한 농도 한계를 파악하는 것이 중요하다. 스캔 속도가 빨라지면 신호 강도가 증가하고 검출 한계 또는 근처에서 단백질 농도를 분석하는 데 도움이 될 수 있다. 다중 전이 단백질의 농도 요건을 파악하기 위해 항체 허셉틴 트라스투주맙(Herceptin Trastuzumab)을 PBS에서 다양한 농도로 조정하여 2 °C/분의 스캔 속도로 3회 반복 평가했다(그림 2 및 표 1).
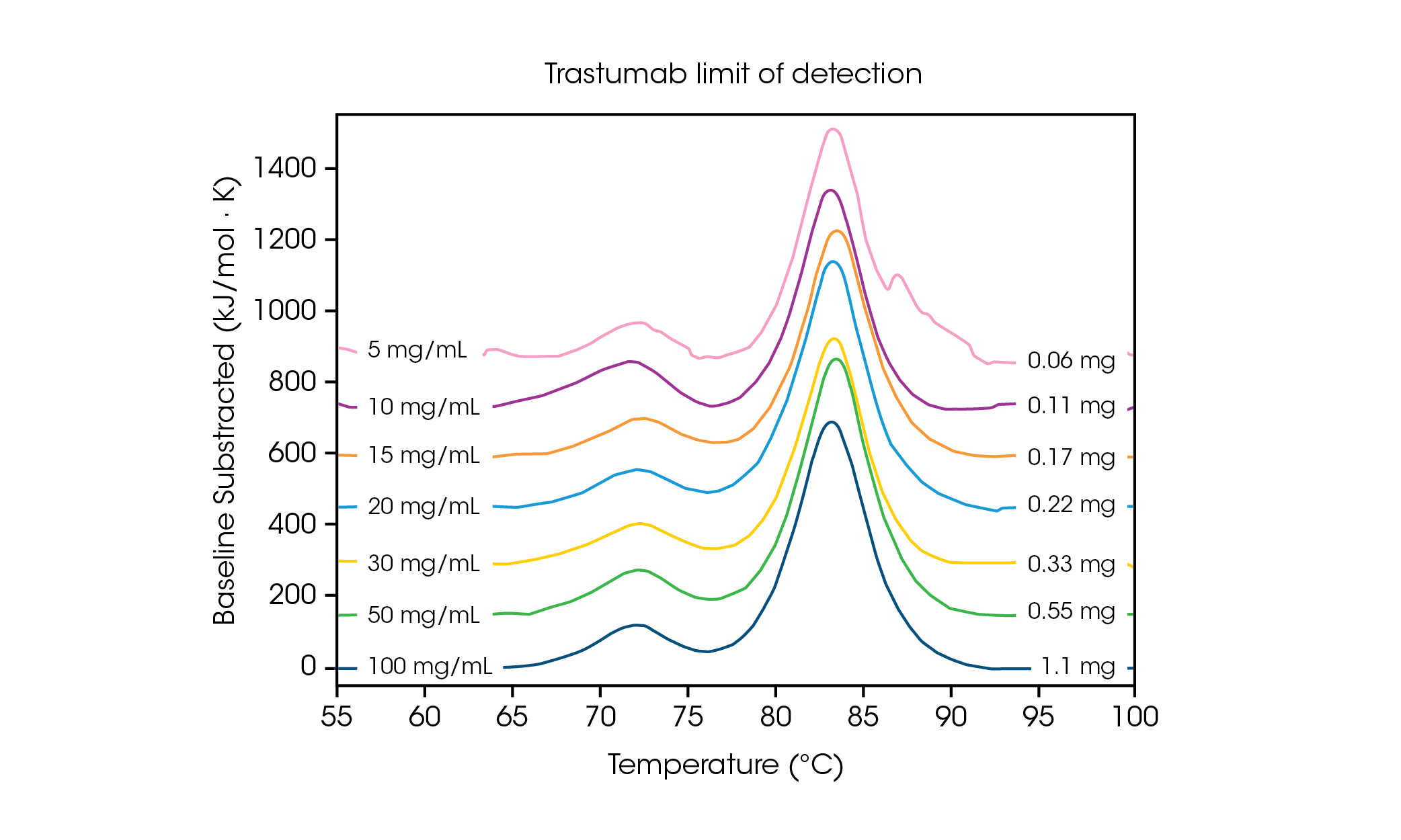
표 1. 검출 한계 스크리닝 전반에 걸친 전이 온도 및 재현성. 평균 ± SD, n = 3.
| Conc. | Tmax,1(°C) | Tmax,2(°C) |
|---|---|---|
| 5 mg/mL | 72.57 ± 0.52 | 83.06 ± 0.09 |
| 10 mg/mL | 71.83 ± 0.29 | 82.98 ± 0.05 |
| 15 mg/mL | 72.13 ± 0.23 | 83.17 ± 0.11 |
| 20 mg/mL | 71.88 ± 0.01 | 82.99 ± 0.08 |
| 30 mg/mL | 71.91 ± 0.12 | 83.10 ± 0.03 |
| 50 mg/mL | 71.93 ± 0.08 | 83.20 ± 0.02 |
| 100 mg/mL | 71.85 ± 0.01 | 83.01 ± 0.01 |
100 mg/mL 농도에서 2개의 전이가 명확하게 보이는데, 이는 평균 Tmax,1 71.85 °C에서의 CH2 도메인 풀림 및 평균 Tmax,2 83.01 °C에서의 결합한 Fab 및 CH3 도메인의 풀림과 상관관계가 있다[2]. 단백질 농도가 감소함에 따라 안정성에 유의미한 변화가 관찰되지 않으며, 열량계 전반에 걸쳐 탁월한 재현성이 관찰된다. 20 mg/mL 허셉틴 트라스투주맙에서 CH2 풀림 전이의 규모는 크게 감소하지만, 3회 반복 샘플 간 탁월한 재현성이 관찰된다(그림 3). 20 mg/mL 미만에서는 CH2 풀림 도메인이 작아지고 분석이 더 어려워지며 감지된 Tmax,1의 변동성이 증가하는 것이 관찰된다. 결합된 Fab 및 CH3 도메인과 같은 보다 큰 규모의 풀림 이벤트(Tmax,2)는 5 mg/mL와 같은 낮은 농도에서도 쉽게 감지된다. 모든 DSC 장비와 마찬가지로 보다 날카롭고 좁은 피크는 최고 수준의 재현성을 제공한다. 검출 한계는 샘플에 따라 다르며, 단백질의 복잡성 및 용액 환경에 따라 달라질 수 있다.
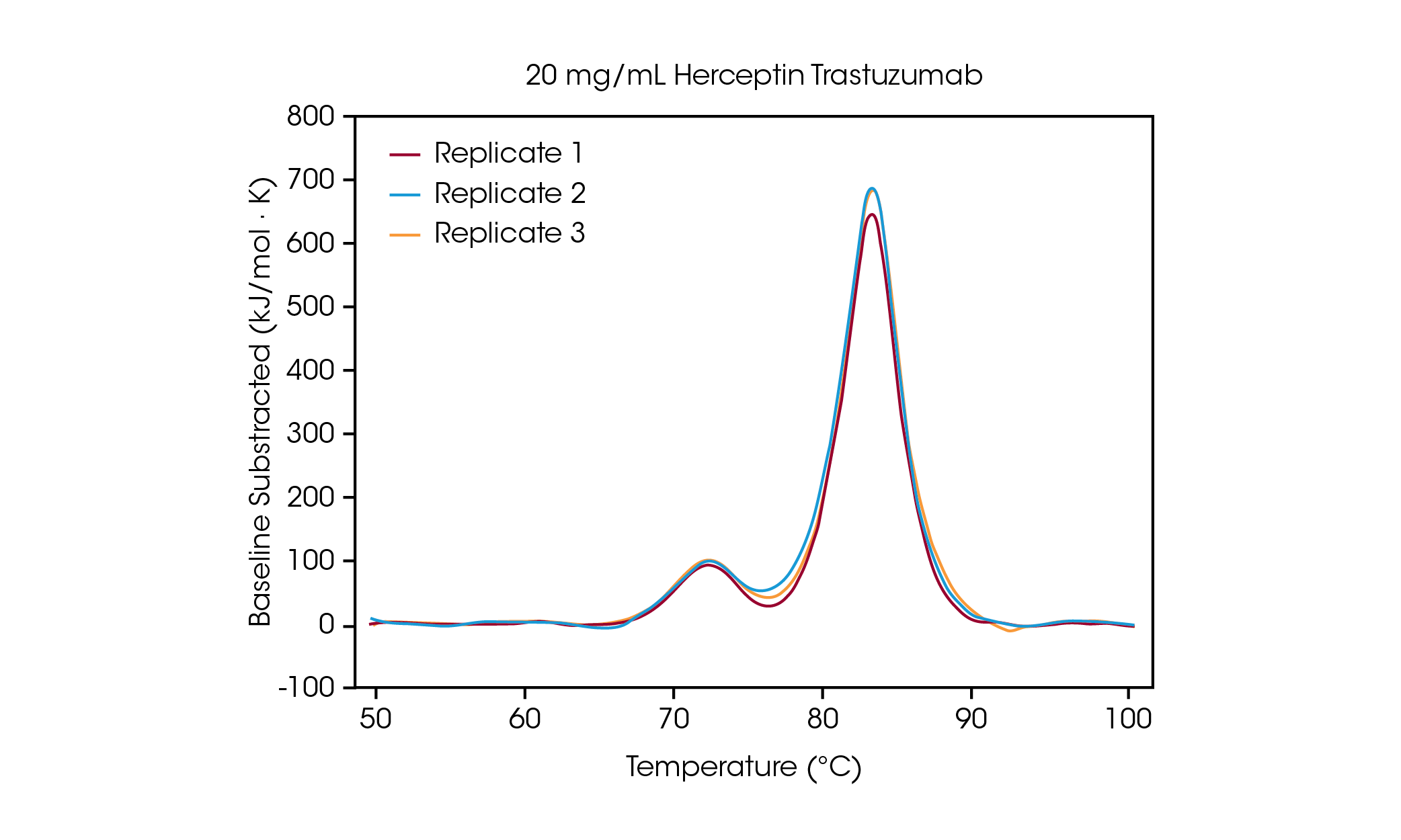
열 안정성에서 농도 의존성 조사
TA Instruments RS-DSC는 항체 약물 및 향체 약물 접합체에 특히 중점을 두고 고농도 생물학적 제제 샘플을 처리할 수 있도록 독특하게 설계되었다. 항체 치료제의 성공이 증가함에 따라, 제약 업계에서는 피하 및 안구를 통한 약물 전달이 가능한 고농도 제형에 대한 관심이 높아졌다. 따라서 50~150 mg/mL의 항체 농도가 일반적이며, 농도는 200 mg/mL까지 높을 수 있다. [3]. 단백질을 고농도로 제제화하면 물리적 불안정성에 대한 민감성이 높아질수 있다[4, 5]. 이와 대조적으로, 일부 사례 연구에 따르면 농도가 증가한 상태에서 열 안정성이 높아진다는 사실이 나타났다[6]. 따라서 관심 제형 농도에서 용액 환경에 대한 열 풀림 및 반응을 이해하는 것은 의약품에 대한 부담을 완화하는 데 필요한 중요한 지표이다.
TA Instruments의 RS-DSC는 일회용 미세유체 칩에 단백질 샘플을 담도록 설계되었다. 기존 미세 열량 측정 장비에는 실험 사이에 청소가 필요한 고정된 샘플 셀이 포함되어 있다. 풀림 과정 중의 침전이나 겔화에 취약한 고농도 샘플은 최선의 시나리오에서도 세척이 어려울 수 있으며, 최악의 경우 셀을 손상시킬 수 있다. TA Instruments RS-DSC에 사용되는 일회용 미세유체 칩은 작동의 편의성을 개선하고 많은 시간이 소요되는 세척 프로토콜이 필요하지 않으면서도 고농도 단백질 샘플에 대한 위험 부담 없이 테스트할 수 있게 한다.
고농도 단백질 샘플을 테스트할 수 있는 능력을 입증하고 원하는 제형 농도에서 테스트를 실시하는 것의 중요성을 설명하기 위해 글리신 완충액에서 계란 흰자 라이소자임 30~330mg/mL을 평가했다(그림 4 및 표 2). 저농도(~1 mg/mL)의 단순 단일 전이 열영상으로, 라이소자임은 일반적으로 DSC의 기준 테스트 샘플로 사용된다. 단백질 농도를 최대 100배까지 높인 상태에서 평가한 결과 라이소자임 안정성의 농도 의존성이 관찰되었다.
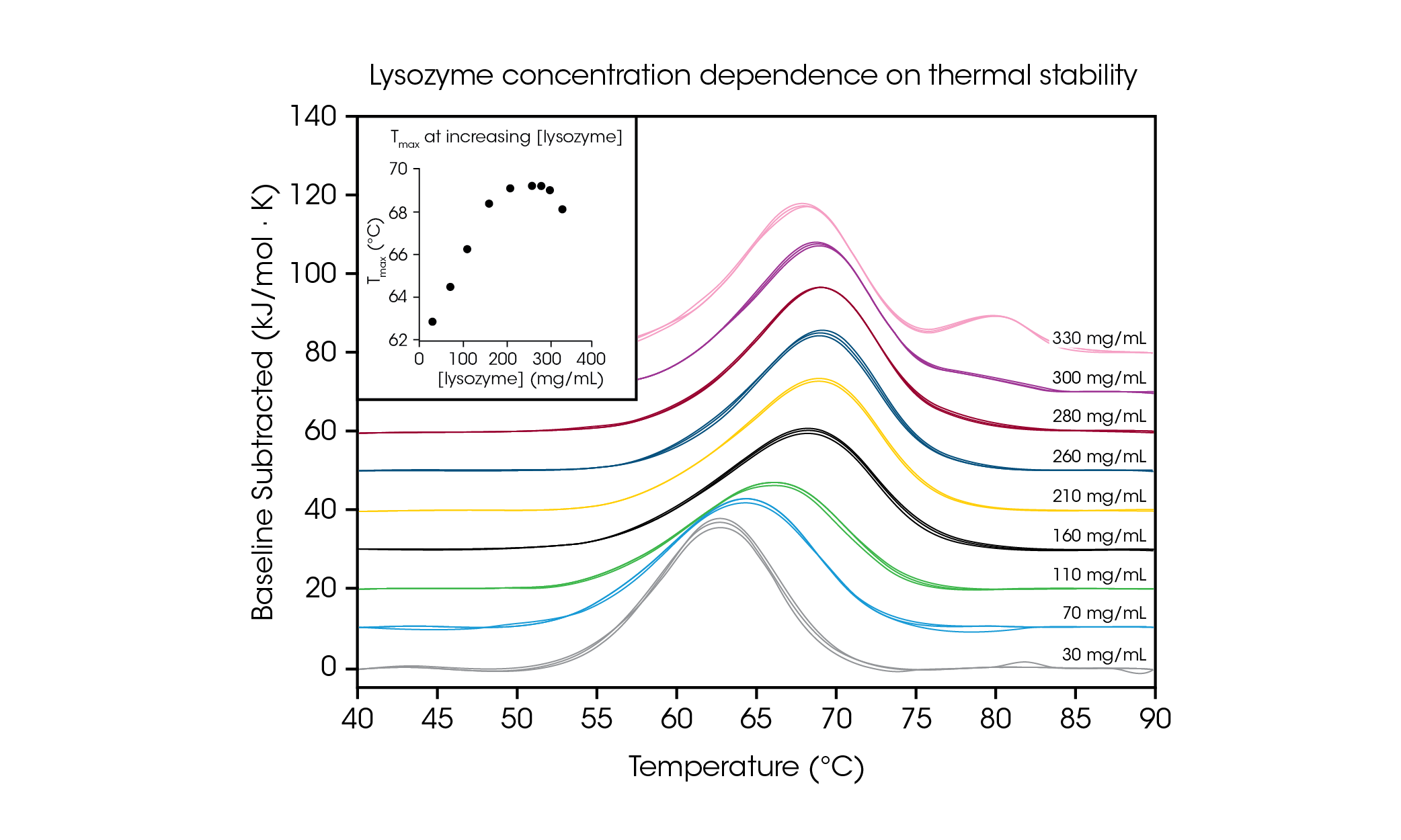
표 2. 라이소자임 농도 의존적 스크리닝 전반에 걸친 전이 온도 및 재현성. 평균 ± SD, n = 3.
| Conc. | Tmax(°C) |
|---|---|
| 330 mg/mL | 68.14 ± 0.05 |
| 300 mg/mL | 69.00 ± 0.04 |
| 280 mg/mL | 69.22 ± 0.04 |
| 260 mg/mL | 69.19 ± 0.09 |
| 210 mg/mL | 69.08 ± 0.06 |
| 160 mg/mL | 68.39 ± 0.04 |
| 110 mg/mL | 66.27 ± 0.09 |
| 70 mg/mL | 64.68 ± 0.05 |
| 30 mg/mL | 62.81 ± 0.06 |
가장 낮은 테스트 농도 30 mg/mL의 경우 라이소자임의 Tmax는 62.81 °C로 측정되었다. 농도가 160 mg/mL까지 증가함에 따라 안정성은 68.39 °C의 Tmax까지 선형적으로 증가했다(그림 4 삽화 참조). 210~280 mg/mL에서 열 안정성은 약 69.2 °C의 Tmax에서 정체되었다. 흥미로운 점은 300 mg/mL의 농도에서 주 전이의 말미에 숄더의 존재가 대략 80 °C 부근에서 관찰되며, 주 전이의 전체적인 안정성이 69.00 °C의 Tmax로 약간 감소한다는 사실이다. 가장 높은 농도인 330 mg/mL에서 주 전이 Tmax,1의 열 안정성은 68.14 °C로 더욱 감소하며 80.28 ± 0.04 °C의 Tmax,2에서 추가적인 피크가 관찰된다. 고농도 테스트 역량을 갖춘 TA Instruments의 RS-DSC를 사용하면 약 300 mg/mL를 초과하는 라이소자임 농도에서 고차 구조의 형성을 관찰할 수 있다. 본 연구는 고농도 단백질을 대상으로 고품질 데이터를 획득하는 능력을 입증하는 것 이외에도, 희석으로 인해 관찰된 단백질의 안정성이 변화할 수 있으므로 생물학적 제제 제품을 원하는 농도에서 테스트하는 것의 중요성을 입증한다.
결론
기존의 단일 샘플 DSC 기술은 정확성이 높지만 대용량의 샘플이 필요하며 약물 개발 공정 중 많은 시간을 소요하는 기술이 될 수 있다. TA Instruments RS-DSC를 이용하면 최대 24개의 샘플을 동시에 분석하여 높은 처리량의 열 안정성 테스트를 수행할 수 있다. 손쉬워진 워크플로, 병렬식 테스트를 통한 빠른 데이터 수집 속도 및 자동화된 피크 감지 알고리즘으로 인한 빠른 분석을 이용하면 결과 도출 시간을 현저히 앞당길 수 있다. 본 연구에서는 농도를 20 mg/mL까지 낮추면서 복잡한 다중 전이 항체 샘플에 대한 정확하고 재현성이 있는 데이터 분석이 가능함을 입증했다. 2 °C/분의 더 빠른 스캔 속도로 인해 진폭이 큰 신호를 얻을 수 있고, 이는 검출 한계 또는 한계 근처에서의 샘플 분석에 도움이 될 수 있다. 최대 농도 330 mg/mL의 고농도 라이소자임 용액을 연구하여 열 안정성에 대한 예상치 못한 농도 의존성을 밝히고, 관심 대상 약물 제품 농도 평가의 중요성을 부각시켰다. 종합적으로 TA Instruments의 RS-DSC는 열응력에 대한 회복력, 제품 품질을 파악하고 규제 승인을 지원하는 데 중요한 변수인 생물약제 안정성 특성 규명을 위한 새로운 플랫폼을 제공한다.
참고 문헌
- “Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters,” ASTM E2603-15, 2023.
- K. J. Arlotta, A. V. Gandhi, H.-N. Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, “In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution,” Antibodies, vol. 7, p. 6, 2018.
- R. G. Strickley and W. J. Lambert, “A review of formulations of commercially available antibodies,” Journal of Pharmaceutical Sciences, vol. 110, pp. 2590-2608, 2021.
- J. Zarzar, T. Khan, M. Bhagawati, B. Weiche, J. Syndow-Andersen and S. Alavattam, “High concentration formulation developability approaches and considerations,” MAbs, vol. 15, pp. 1-13, 2023.
- S. J. Shire, Z. Shahrokh and J. Liu, “Challenges in the development of high protein concentration formulations,” Journal of Pharmaceutical Sciences, vol. 93, pp. 1390-1402, 2004.
- C. Zhang, J. W. Bye, L. H. Lui, H. Zhang, J. Hales, S. Brocchini, R. A. Curtis and P. A. Dalby, “Enhanced Thermal Stability and Reduced Aggregation in an Antibody Fab Fragment at Elevated Concentrations,” Molecular Pharmaceutics, vol. 20, pp. 2650-2661, 2023.
여기를 클릭하여 이 애플리케이션 노트의 인쇄용 버전을 다운로드해 주십시오.

