關鍵字:差示掃描量熱儀,高通量熱穩定性篩選,短期熱穩定性
MC177-TW
摘要
生物治療熱穩定性測試對於確保產品品質和支持生物藥品的監管審批至關重要。TA Instruments™ RS-DSC(快速篩選差示掃描量熱儀)提供了一個可同時分析多達 24 個樣本的平台。此外,還可使用低容量一次性微流體晶片對高濃度蛋白質候選藥物進行評估。本應用說明透過評估檢測極限並證明適合差示掃描量熱法 (DSC) 分析的濃度範圍,提供證明 TA Instruments RS-DSC 實用性的數據。
引言
短期熱穩定性測試對於評估化合物的熱應力抗性至關重要,這是預測保存期和維持功效的關鍵。差示掃描量熱法 (DSC) 是一種用於暸解抗體結構的技術,但傳統儀器難以對製劑配方濃度樣本進行特性分析。這些挑戰源於使用不可替代的樣本池,因此必須採取冗長的清潔步驟,以防止掃描之間有樣本殘留。固定樣本槽也限制了濃度上限範圍,因為高濃度蛋白質在加熱時更容易堵塞樣本槽。在最好的情況下,堵塞的樣本池需要進行大量且徹底的清洗才能重新恢復功能。在最壞的情況下,細胞會受到不可逆的污染。因此,樣本需要從其製劑配方濃度中進行稀釋。濃度會影響蛋白質的熱穩定性,因此要準確暸解潛在藥物在儲存條件下的蛋白質穩定性,就需要對配方強度樣本進行測試。
TA Instruments 的 RS-DSC 是一種創新的差示掃描量熱法技術。與其他 DSC 不同,TA Instruments 的 RS-DSC 無需稀釋樣本,因為它設計獨特,可在低容量及一次性微流體晶片中處理高濃度生物藥物製劑配方。這項技術整合可免去儀器在運行之間重複清潔儀器測量槽,故而可節省時間、降低污染風險,並使讀數更加精確可靠。樣本的製備、密封和分析準備可在一分鐘內完成,只需極少量的樣本即可進行精確評估。TA Instruments RS-DSC 重新定義了熱穩定測試領域,可同時分析 24 個樣本 – 為生物製藥產業提供了一個新的高通量熱穩定性測試平台。透過熱分析提供全面的物理化學見解,可加速藥品的開發,使其有效地推向市場。

實驗與方法
Herceptin™ Trastuzumab 是按照包裝說明在組胺酸配置緩衝液 (18.4 mg/mL 海藻糖二水合物、0.08 mg/mL 聚山梨醇酯 20、0.49 mg/mL 組胺酸鹽酸鹽、0.32 mg/mL 組胺酸,pH 6.0) 於 21 mg/mL 濃度下配置的,並於使用前儲存於 4 °C 的溫度下。在磷酸鹽緩衝液 (PBS) 中進行分析時,抗體將使用 Amicon™ Ultra 10kDa 分子量截留離心式旋轉過濾器進行緩衝液交換,轉移到由 Gibco™ DPBS 和 pH 值為 7.4 的 1 mM EDTA 組成的 PBS 中,調整至所需濃度,然後進行三次重複測試。
用於評估高濃度蛋白質溶液的雞蛋白溶菌酶來自西格瑪奧瑞奇 (Sigma Aldrich) 公司(品號:L6876),在甘胺酸緩衝液(0.1 M 甘氨酸,pH 值 2.5)中配製。使用 Amicon Ultra 3kDa 分子量截留離心式旋轉過濾器將蛋白質樣本濃縮至 330 mg/mL。將濃縮溶液進行稀釋。將在蛋白質濃度製備後,立即於 TA Instruments RS-DSC 上進行三次重複實驗。
用移液器將蛋白質樣本直接吸入一次性玻璃微流體晶片 (MFC) 中,該晶片設計有可容納 11 μL 液體樣本的通道。加入蛋白質溶液後,微流體晶片將用帶有黏著劑的玻璃蓋玻片密封,於加熱至 100 °C 過程中容納樣本。將組裝好的 MFC 放到 TA Instruments RS-DSC (圖 1 ) 中每個雙卡計的樣本側。參考側留有一塊可重複使用的聚醚醚酮 (PEEK) 晶片。最多可同時運作 24 個樣本,最大溫度範圍為 20 – 100 °C,預設掃描速率為 1 或 2 °C/分鐘。由於無需在掃描之間進行清潔,因此在一個典型工作日內最多可運行 96 個樣本。
使用 RS-DSCRun 軟體操作的 TA Instruments RS-DSC,設定為在每次掃描開始前 1800 秒達到初始溫度平衡。每個樣本一式三份,並在整個溫度範圍(20 至 100 °C)內,以 1 或 2 °C/分鐘的速度進行掃描。
為確保所有 24 個量熱儀的準確性,醯磷脂醯膽鹼 (DPPC) 對儀器進行了校準和驗證,每個量熱儀的 Tmax 與預期文獻值的偏差小於 0.2 °C [1]。
數據資料將使用 NanoAnalyze™ 軟體 (v4.0.0) 進行處理。新的軟體功能可自動檢測變性中點溫度 (Tmax),並對多達 96 個熱像圖進行比較。NanoAnalyze 軟體 v4.0.0 包括一種新的軟體演算法,RapidDSC,可透過搜尋指定數據範圍內的峰值來自動檢測 DSC 熱像圖中的 Tmax。自動基準線被應用於整個峰值,並用於精確調整 Tmax 溫度,以提高準確性。自動峰值檢測功能最多可在相關溫度範圍內顯示三個峰值。自動化功能可在彈出「基準線和 Tmax 編輯器」視窗中輕鬆編輯,縮小檢測視窗,選擇特定範圍進行峰值識別,或調整自動化基準線和 Tmax。來自 Tmax 自動化的表格數據可以匯出,便於輕鬆進行比較,或者在 RapidDSC 的 Tmax 視覺化和覆蓋分頁中查看。
結果與討論
TA Instruments RS-DSC 檢測極限
由於對樣品量的要求不高,因此暸解靈敏度和數據準確性所需的濃度極限非常重要。更快的掃描速率可提高訊號強度,有助於分析檢測極限或接近檢測極限的蛋白質濃度。為暸解多轉換蛋白的濃度需求,將抗體 Herceptin Trastuzumab 在PBS 中調整為不同濃度,並以 2 °C/min 的掃描速率進行三次重複的評估(圖 2 和表 1)。
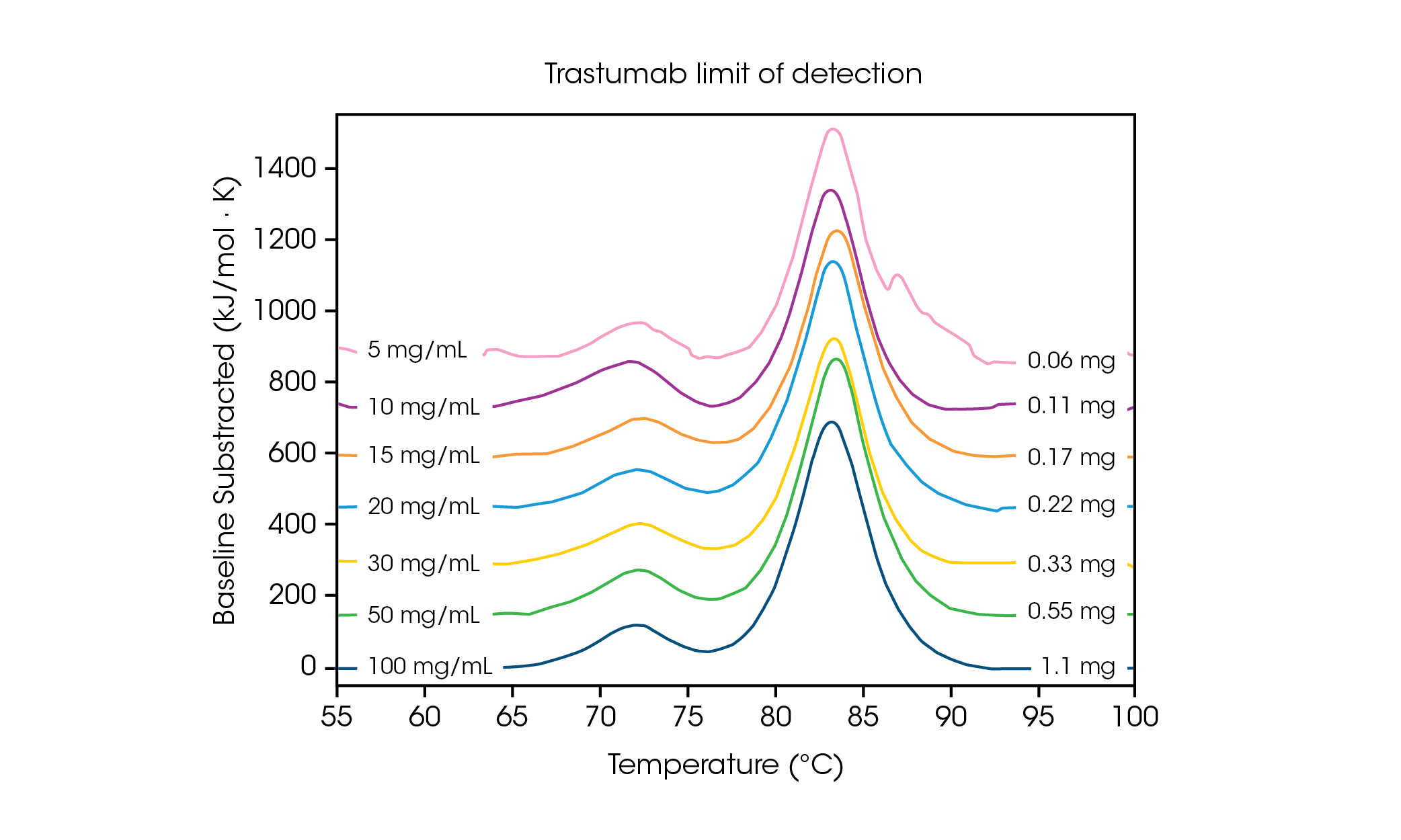
表1. 在檢測極限範圍內的轉換溫度和再現性。平均值 ± 標準差, n = 3。
| 濃度 | Tmax,1 (°C) | Tmax,2 (°C) |
|---|---|---|
| 5 mg/mL | 72.57 ± 0.52 | 83.06 ± 0.09 |
| 10 mg/mL | 71.83 ± 0.29 | 82.98 ± 0.05 |
| 15 mg/mL | 72.13 ± 0.23 | 83.17 ± 0.11 |
| 20 mg/mL | 71.88 ± 0.01 | 82.99 ± 0.08 |
| 30 mg/mL | 71.91 ± 0.12 | 83.10 ± 0.03 |
| 50 mg/mL | 71.93 ± 0.08 | 83.20 ± 0.02 |
| 100 mg/mL | 71.85 ± 0.01 | 83.01 ± 0.01 |
在 100 mg/ml 的濃度下,可以清楚地看到兩個轉換溫度,分別是與 CH2 結構域展開相關的溫度,其平均 Tmax,1 為 71.85 °C,和與結合 Fab 和 CH3 結構域展開相關的溫度,其平均 Tmax,2 為 83.01 °C [2]。隨著蛋白質濃度的降低,穩定性沒有明顯變化,而且不同熱量儀之間的再現性極佳。在濃度為 20 mg/mL 的 Herceptin Trastuzumab 中, CH2 結構展開轉換的幅度明顯減小,但在三個重複樣本中觀察到極佳的再現性(圖 3)。在濃度低於 20 毫克/毫升時,對較小的 CH2 展開結構域進行分析變得更具挑戰性,觀測到的 Tmax,1 變異性也會增加。如結合 Fab 和 CH3 結構域 (Tmax,2) 等較大結構域展開更容易被檢測到,即使濃度低至 5 mg/mL。與所有 DSC 儀器一樣,更尖銳、更狹窄的峰值可提供最高的再現性。檢測極限與樣本有關,可能因蛋白質的複雜性和溶液環境而異。
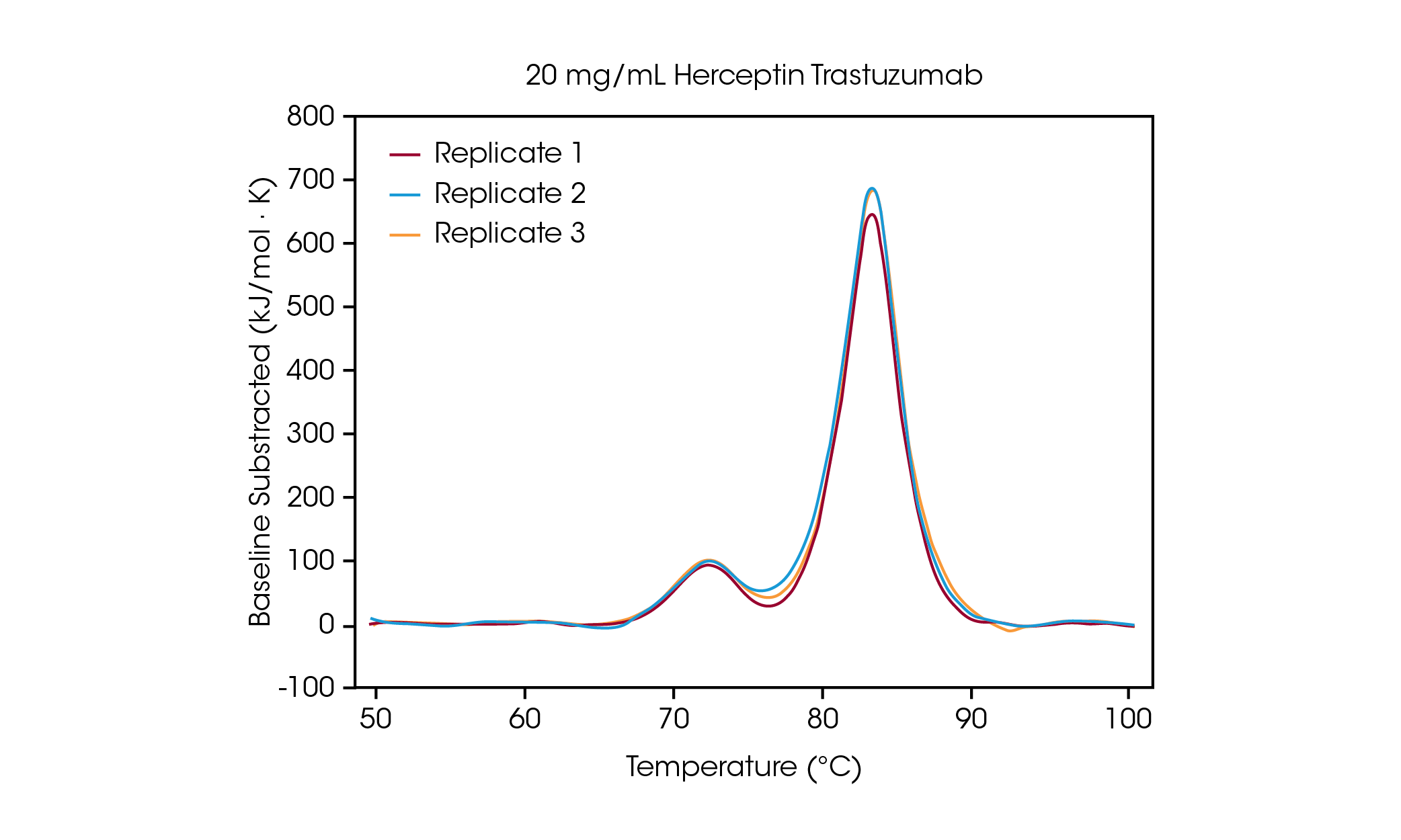
熱穩定性的濃度依賴性研究
TA Instruments RS-DSC 設計獨特,可處理高濃度生物製劑藥物樣本,特別適用於抗體藥物和抗體藥物複合物。隨著抗體療法日益成功,製藥產業對可實現皮下和眼部給藥的高濃度劑型越來越感興趣。因此,抗體濃度為 50 – 150 mg/mL 的製劑很常見,有的甚至高達 200+ mg/ml [3]。配製高濃度蛋白質會增加對物理不穩定性的敏感性[4, 5]。反之,在某些情況下,研究表明,當濃度增加時,熱穩定性會增強 [6]。因此,暸解在感興趣的配方濃度下,熱展開和對溶液環境的反應是減輕藥物產品風險的關鍵指標。
TA Instruments 的 RS-DSC 被設計用在一次性微流體晶片中保存蛋白質樣本。傳統的微量熱儀包含一個固定的樣本槽,需要在兩次實驗之間進行清潔。高濃度樣本在展開過程中容易沉澱或凝膠化,輕則難以清洗,重則可能損壞樣本槽。TA Instruments RS-DSC 中使用的一次性微流體晶片不僅提高了操作的簡便性,省去了耗時的清洗過程,還能對高濃度蛋白質樣本進行無風險檢測。
為了展示測試高濃度蛋白質樣本的能力,並說明在所需製劑濃度下進行測試的重要性,我們對甘胺酸緩衝液中 30 – 330 mg/mL 的雞蛋白溶菌酶進行了評估(圖 4 和表 2)。溶菌酶在低濃度(約 1 mg/mL)時,僅顯示簡單的單一轉變熱像圖,通常用作 DSC 的參考測試樣本。透過對濃度高達 100 倍的蛋白質進行評估,我們觀察到溶菌酶的穩定性與濃度有關。
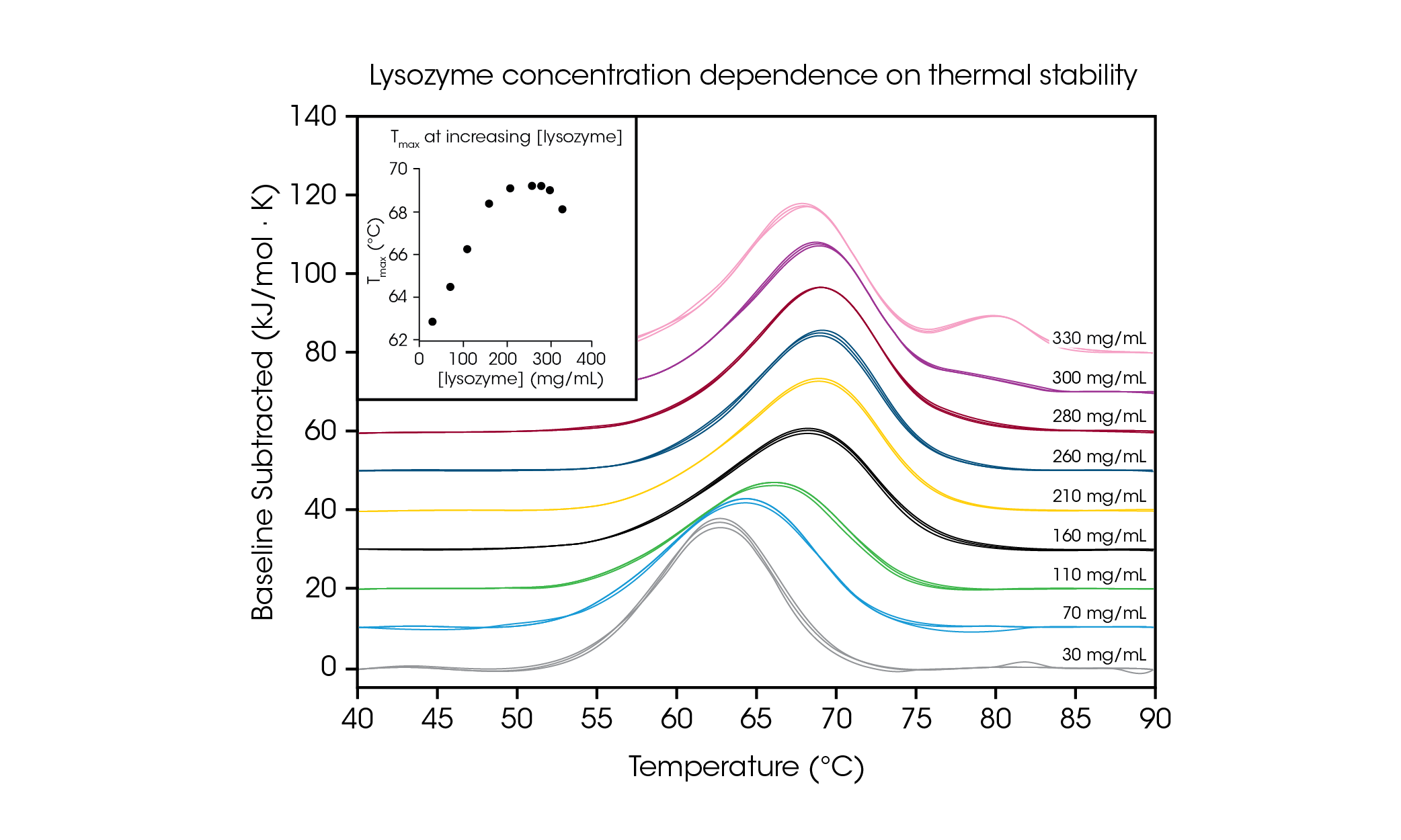
表 2. 溶菌酶濃度依賴性篩選中的轉換溫度與再現性。平均值 ± 標準差, n = 3。
| 濃度 | Tmax (°C) |
|---|---|
| 330 mg/mL | 68.14 ± 0.05 |
| 300 mg/mL | 69.00 ± 0.04 |
| 280 mg/mL | 69.22 ± 0.04 |
| 260 mg/mL | 69.19 ± 0.09 |
| 210 mg/mL | 69.08 ± 0.06 |
| 160 mg/mL | 68.39 ± 0.04 |
| 110 mg/mL | 66.27 ± 0.09 |
| 70 mg/mL | 64.68 ± 0.05 |
| 30 mg/mL | 62.81 ± 0.06 |
在最低測試濃度(30 mg/mL)下,溶菌酶的 Tmax 為 62.81 °C。當濃度增加到 160 mg/mL 時,呈現穩定線性上升趨勢(見圖 4 插圖),Tmax 為 68.39 °C。在濃度 210 – 280 mg/mL 範圍內,熱穩定性約維持在 ~ 69.2 °C 的 Tmax 溫度上。有趣的是,當濃度為 300 mg/mL 時,在 80 °C 左右,開始觀察到主要轉換尾端出現了肩峰,主要轉換的整體穩定性略有下降,Tmax 為 69.00 °C。在 330 mg/mL 的最高濃度下,主要轉變的熱穩定性 Tmax,1 進一步下降到 68.14 °C,並觀察到一個額外的峰值,即 Tmax,2 為 80.28 ± 0.04 °C。TA Instruments 的 RS-DSC 具有高濃度測試能力,可在溶菌酶濃度大於 ~300 mg/mL 時觀察高階結構的形成。這項研究不僅證明了在高濃度蛋白質條件下,獲得高品質數據的能力,還證明了在相關濃度條件下,測試生物藥物產品的重要性,因為稀釋可能會改變所觀察到的蛋白質穩定性。
結論
傳統的單一樣本 DSC 技術精準度高,但需要大量樣本,在藥物開發過程中是一項耗時的技術。TA Instruments RS-DSC 可同時分析多達 24 個樣品,進行更高通量的熱穩定性測試。更簡單的工作流程、透過平行測試提高的數據資料擷取率,以及透過自動峰值偵測演算法加快分析速度,都大大縮短了得出結果的時間。以下是對低至 20 mg/mL 的複合多重過渡抗體樣本的精確可重複分析。更快的 2 °C/min 掃描速度會導致更高的訊號振幅,有助於分析檢測極限或接近檢測極限的樣本。對高達 330 mg/mL 的高濃度溶菌酶溶液進行研究後發現,熱穩定性與濃度有著出乎意料的相關性,這也凸顯了評估相關藥物-產品濃度的重要性。總之,TA Instruments 的 RS-DSC 為分析生物治療穩定性特性提供了一個新平台,而生物治療穩定性是暸解熱應力抗性、產品品質和支持監管審批的一個重要變數。
參考資料
- “Standard Practice for Calibration of Fixed-Cell Differential Scanning Calorimeters,” ASTM E2603-15, 2023.
- K.J. Arlotta, A. V. Gandhi, H.-N.Chen, C. S. Nervig, J. F. Carpenter and S. C. Owen, “In-Depth Comparison of Lysine-Based Antibody-Drug Conjugates Prepared on Solid Support Versus in Solution,” Antibodies, vol. 7, p. 6, 2018.
- R.G. Strickley and W. J. Lambert, “A review of formulations of commercially available antibodies,” Journal of Pharmaceutical Sciences, vol. 110, pp. 2590-2608, 2021.
- J.Zarzar, T. Khan, M. Bhagawati, B. Weiche, J. Syndow-Andersen and S. Alavattam, “High concentration formulation developability approaches and considerations,” MAbs, vol. 15, pp. 1-13, 2023.
- S.J. Shire, Z. Shahrokh and J. Liu, “Challenges in the development of high protein concentration formulations,” Journal of Pharmaceutical Sciences, vol. 93, pp. 1390-1402, 2004.
- C.Zhang, J. W. Bye, L. H. Lui, H. Zhang, J. Hales, S. Brocchini, R. A. Curtis and P. A. Dalby, “Enhanced Thermal Stability and Reduced Aggregation in an Antibody Fab Fragment at Elevated Concentrations,” Molecular Pharmaceutics, vol. 20, pp. 2650-2661, 2023.
請按此處下載本應用說明的可列印版本。

