Palabras clave: DSC, MDSC, batería de iones de litio, electrolitos, baja temperatura
TA468-ES
Resumen
Los electrolitos de las baterías de iones de litio deben permanecer en estado líquido para que el transporte iónico y el desempeño de la batería sean óptimos. Comprender la transición de fase de los electrolitos es fundamental para mejorar el desempeño de las baterías a bajas temperaturas, especialmente en climas más fríos. La calorimetría diferencial de barrido (DSC) ofrece un sencillo mecanismo de medición para evaluar la cristalización y fusión de los electrolitos. Los electrolitos de alta concentración pueden sobreenfriarse y permanecer en estado líquido bajo condiciones de enfriamiento rápido, lo que provoca su cristalización al calentarse. La cristalización en frío y la fusión resultantes pueden superponerse en el mismo intervalo de temperatura, algo que un experimento de DSC tradicional no podría analizar completamente. La DSC modulada separa la cristalización en una señal de flujo de calor sin inversión y la fusión en una señal de flujo de calor con inversión. Esto permite una integración clara y precisa de la entalpía relacionada con la cristalización y la fusión de forma individual, proporcionando una mayor comprensión del mecanismo de transición de fase dentro de un intervalo de temperaturas. En este trabajo se evalúan dos electrolitos disponibles en el mercado para comprender las transiciones a bajas temperaturas que podrían afectar al desempeño de las baterías.
Introducción
Los electrolitos de las baterías de iones de litio (LIB) permiten que los iones fluyan entre el cátodo y el ánodo para cargar y descargar la batería. Uno de los desafíos principales es lograr una alta densidad energética manteniendo la estabilidad y la longevidad en diversas condiciones de funcionamiento. La formulación del electrolito contiene una sal, normalmente LiPF6, en una solución acuosa u orgánica [1]. El carbonato de etileno (EC), el carbonato de etilmetilo (EMC) y el carbonato de dimetilo (DMC) se utilizan a menudo pero pueden estar limitados a voltajes más altos debido a la oxidación. La adición de aditivos a la fórmula ayuda a permitir altos voltajes al mismo tiempo que limita la concentración de EC, lo que beneficia el funcionamiento a bajas temperaturas [2] [3].
Una queja común con respecto a las LIB es la reducción de su eficiencia a bajas temperaturas. Si el electrolito se congela, el transporte iónico se reduce y el desempeño de la batería se ve afectado. El análisis de electrolitos para identificar transiciones de fase a bajas temperaturas ofrece una valiosa herramienta para la formulación y ayuda a predecir el desempeño de la batería en las condiciones de funcionamiento. La calorimetría diferencial de barrido (DSC) constituye un método sencillo para medir el cambio de flujo de calor durante la transición de fase de un material. El DSC Discovery de TA Instruments puede utilizarse para realizar ensayos de DSC tradicional y DSC modulada (MDSC) con el objetivo de comprender la transición de fase de los electrolitos, como la cristalización, las temperaturas de fusión y las entalpías de transición de fase.
La DSC tradicional mide el flujo de calor como una función de la temperatura de rampa lineal en una muestra; la MDSC aporta una perspectiva adicional a un ensayo de DSC tradicional aplicando una modulación sinusoidal a una velocidad de calentamiento promedio [4] [5]. La señal inversa en la MDSC es la respuesta del flujo de calor a la velocidad de calentamiento y mide la capacidad calorífica (Cp), los cambios en la capacidad calorífica y la fusión cristalina. La señal no inversa mide la respuesta del flujo de calor a la temperatura absoluta y al tiempo, capturando procesos cinéticos como la cristalización, la descomposición, la evaporación, la relajación molecular y las reacciones químicas. La capacidad de resolver transiciones complejas en componentes específicos a partir de mediciones de MDSC mejora la interpretación de los datos. En esta nota, se utiliza un calorímetro diferencial de barrido (DSC) de TA Instruments para realizar mediciones tanto tradicionales como MDSC de electrolitos de LIB a fin de comprender la transición de fase como una función de la temperatura.
Experimental
Para fines del presente estudio, SpectraPower (Livermore, CA) suministró dos tipos de electrolitos comerciales, y ambos se denominaron electrolito A y B, respectivamente. Un DSC de TA Instruments con tecnología Tzero midió la señal de flujo de calor durante el calentamiento y enfriamiento de las muestras de electrolitos. Se prepararon muestras de aproximadamente 10 mg dentro de una bolsa de guantes y se sellaron en un recipiente hermético Tzero. Las muestras se enfriaron primero a -120 °C y después se aceleraron a 10 °C/min desde
-120 °C hasta 40 °C para evaluar la congelación y la fusión del electrolito.
Se midieron el inicio y el pico de las temperaturas de cristalización y fusión, así como la entalpía de la transición de fase.
La MDSC se llevó a cabo utilizando el método de solo calor modulado, el cual se muestra en la Tabla 1 con un periodo de modulación de 60 s y una rampa de calentamiento de 2 °C/min desde -120 °C hasta 40 °C.
Tabla 1. Procedimiento de solo calor modulado para la MDSC
| Ensayo | Solo calor modulado |
|---|---|
| Período de modulación | 60 sec |
| Velocidad de rampa | 2 °C/min |
| Temperatura inicial | -120 °C |
| Temperatura final | 40 °C |
Resultados y discusiones
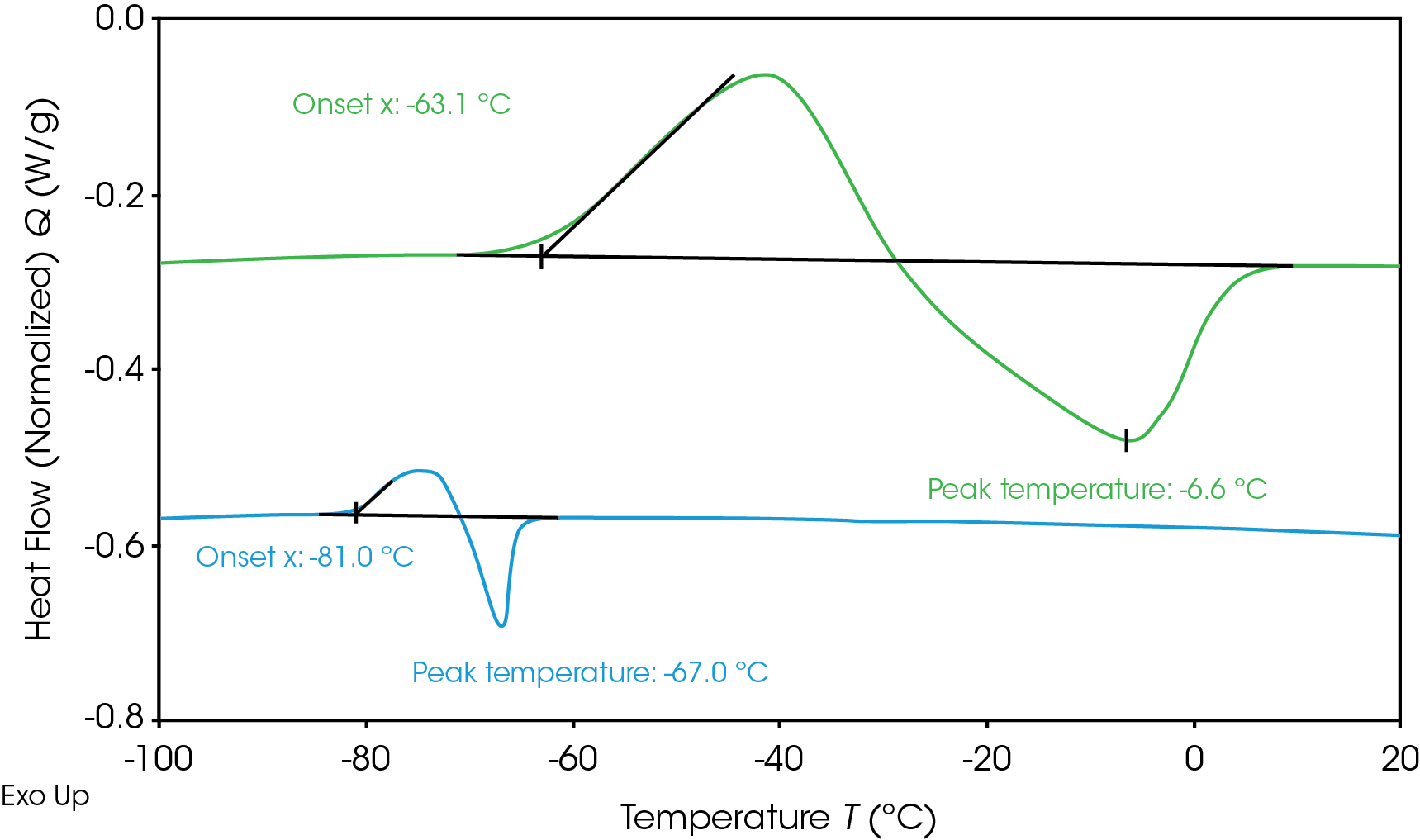
La determinación de las transiciones de fase del electrolito ayuda a prevenir la congelación durante el funcionamiento de la batería a bajas temperaturas. En la Figura 1 se muestra el flujo de calor del electrolito durante la congelación y descongelación medido mediante DSC. Los electrolitos se enfriaron hasta -120 °C y luego se calentaron para medir la transición de fase. Ninguno de los electrolitos mostró cristalización durante el enfriamiento, dando lugar a una solución sobreenfriada; sin embargo, ambos se cristalizaron al calentarse (cristalización en frío) [6]. El electrolito A (verde) muestra un inicio de la cristalización a -63.1 °C y un pico de fusión a -6.6 °C. El electrolito B (azul) muestra un inicio de cristalización más bajo a -81 °C y un pico de fusión a -67 °C. La temperatura de fusión más baja es deseable para el funcionamiento a temperaturas más frías, ya que el electrolito permanecerá líquido dentro de un intervalo de temperaturas más amplio. Cuando el electrolito se congela y cristaliza, la movilidad de los iones de litio se ve limitada, lo que afecta el desempeño de la batería. Es posible realizar ajustes en la formulación del electrolito para influir en la transición de congelación o en el sistema de gestión térmica para evitar que la batería alcance la temperatura de inicio de la congelación.
La transición superpuesta experimentada por el electrolito A durante la congelación y la fusión puede entenderse mejor mediante un análisis de MDSC. Durante la MDSC de solo calor, la temperatura modulada nunca disminuye y la muestra nunca se enfría para evitar el impacto del enfriamiento inducido en la cristalización [7]. La MDSC separa la superposición de la cristalización y la transición de fusión (Figura 1) para distinguir la cristalización en señales de flujo de calor sin inversión y la fusión en señales de flujo de calor con inversión (Figura 2). La separación permite una integración clara de la entalpía relacionada con la cristalización y la fusión de forma individual. La entalpía de cristalización resultante del electrolito A es de 28.8 J/g y la entalpía de fusión es de 28.8 J/g, lo que indica que toda la cristalinidad se formó durante la cristalización en frío al calentar. La lenta velocidad de calentamiento de 2 °C/min que se utiliza en la MDSC en comparación con la DSC tradicional a 10 °C/min también mejora la resolución y revela un pico de cristalización adicional a -63.7 °C y -52.7 °C. La fusión se produjo inmediatamente después de la cristalización principal y el pico a -5.6 °C.
El electrolito B, mostrado en la Figura 3, presenta dos picos separados de cristalización y fusión. Al igual que el electrolito A, la entalpía total de cristalización (21.3 J/g) y la entalpía total de fusión (21.3 J/g) similares del electrolito B indican que todo el material cristalino se formó durante la cristalización en frío al calentarse. Las entalpías totales pueden separarse en dos para una evaluación posterior del mecanismo de cristalización y fusión del electrolito B.
El software TRIOS puede analizar la integración mediante la función “dividir pico” para mostrar cada entalpía regional y el porcentaje de área, revelando qué parte de la entalpía individual se produjo durante cada evento de cristalización y fusión. Como se observa en la Tabla 2, aunque la entalpía total de fusión y cristalización es la misma, la entalpía de la primera cristalización (14.9 J/g) y la siguiente fusión (12.8 J/g) no son equivalentes. La cristalización posterior
(6.5 J/g) se produce y sigue a una fusión final (8.5 J/g). Esto indica una cristalización y fusión heterogéneas de los materiales. A lo largo de la temperatura del proceso, existen diferentes fases a una temperatura dada y este análisis proporciona información sobre el mecanismo de transición de fase.
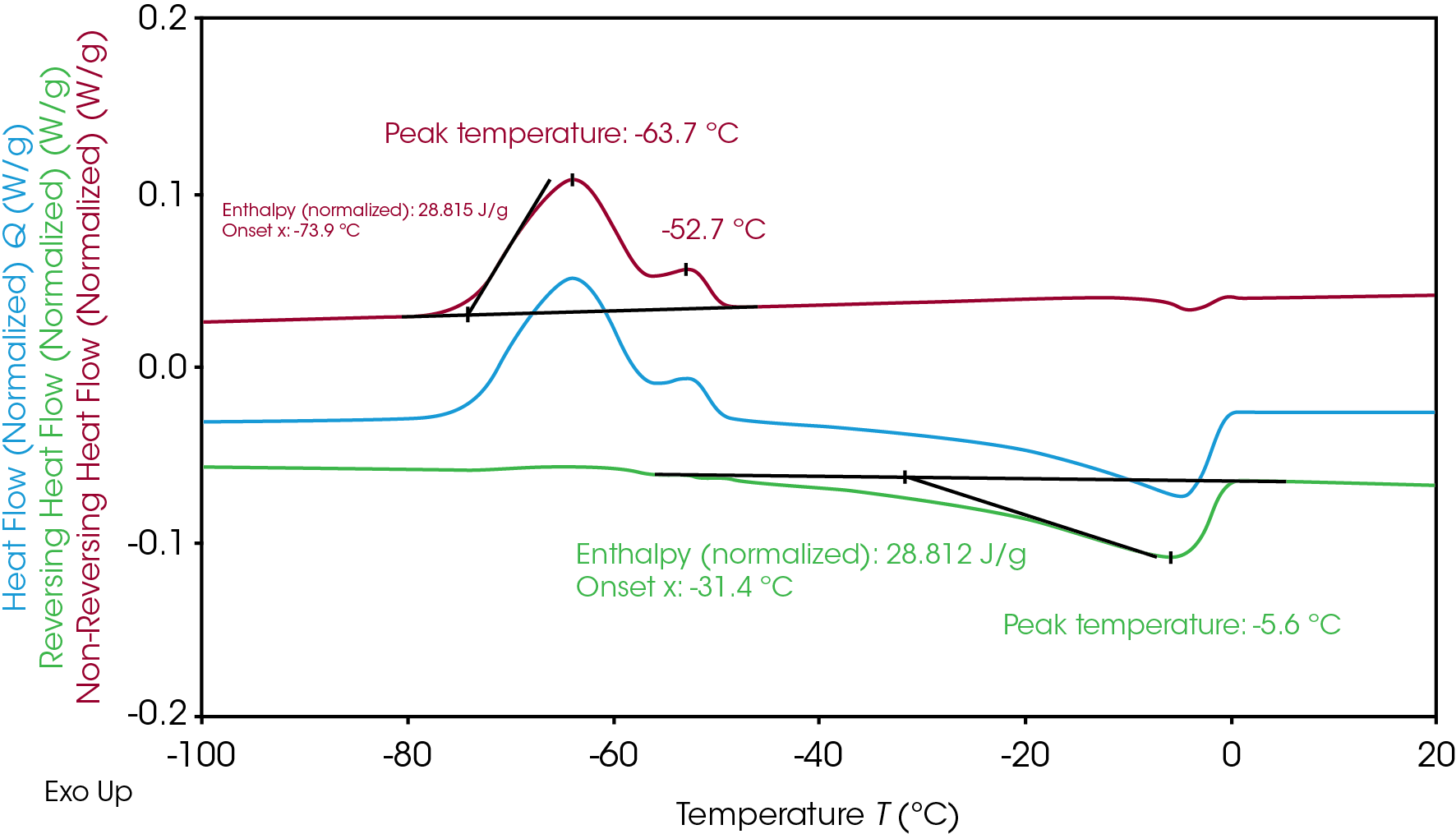
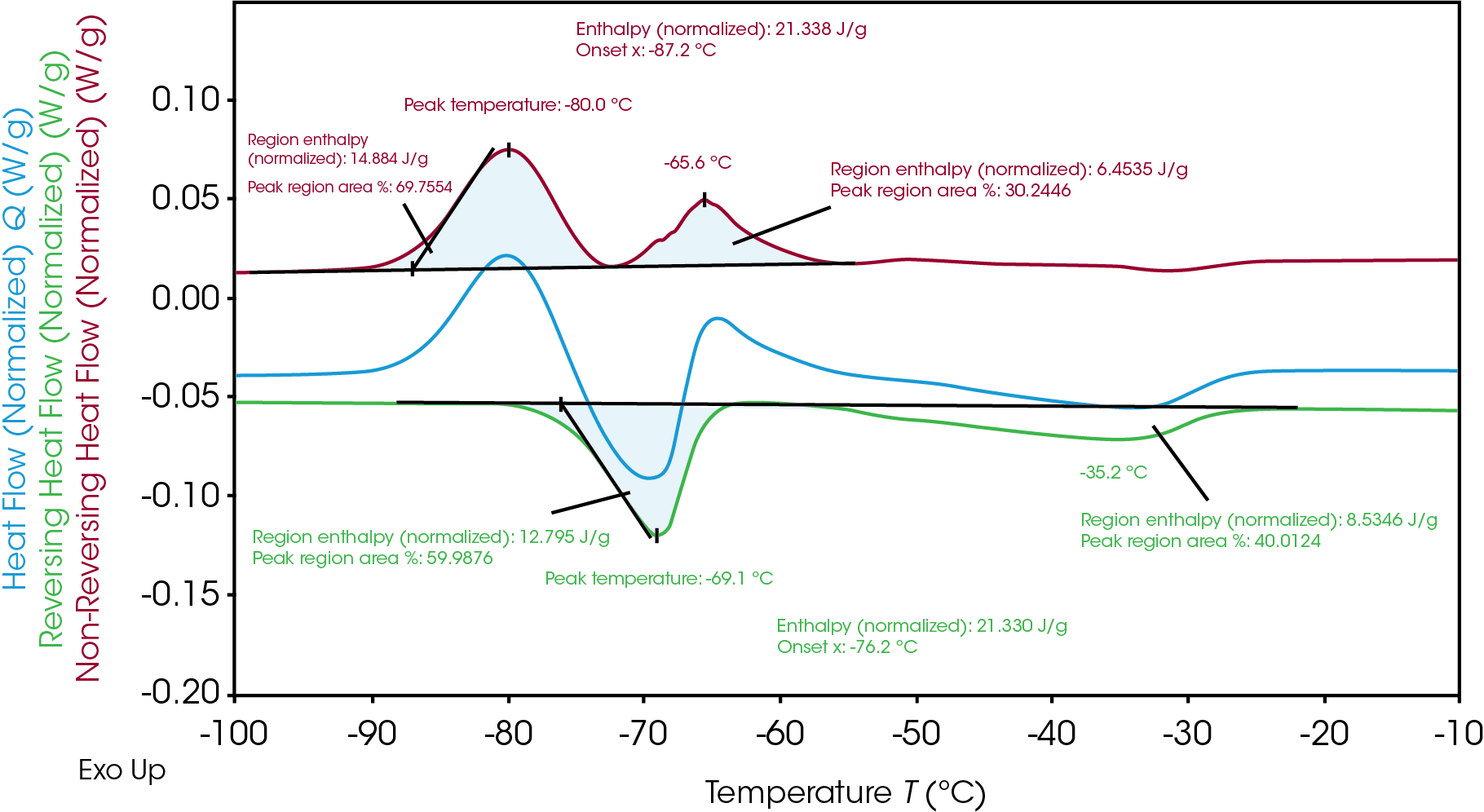
Tabla 2. Desglose de las entalpías de cristalización y fusión del electrolito B
| Temperatura pico (°C) | Entalpía (J/g) | Señal de flujo de calor | |
|---|---|---|---|
| 1ª cristalización | -80.0 | 14.9 | Sin inversión |
| 1ª fusión | -69.1 | 12.8 | Con inversión |
| 2ª cristalización | -65.6 | 6.5 | Sin inversión |
| 2ª fusión | -35.2 | 8.5 | Con inversión |
Conclusiones
Comprender las transiciones de fase de los electrolitos es fundamental para el desempeño de las baterías de iones de litio a baja temperatura. La calorimetría diferencial de barrido mide el flujo de calor de los electrolitos y puede utilizarse para determinar las temperaturas de inicio de la congelación y la fusión. La MDSC ofrece la ventaja de separar la cristalización y la transición de fusión que a veces se producen en el mismo intervalo de temperatura. Mediante esta técnica, los investigadores pueden investigar nuevas formulaciones para mejorar el desempeño de las baterías a bajas temperaturas y los fabricantes pueden emplear un equipo de DSC para el control de calidad de los electrolitos.
Referencias
-
- H. Yang, G. V. Zhuang and P. N. Ross Jr., “Thermal Stability of LiPF6 salt and Li-ion battery electrolytes containing LiPF6,” Journal of Power Sources, vol. 161, pp. 573-579, 2006.
- E. R. Logan, E. M. Tonita, K. L. Gering, L. Ma, M. K. G. Bauer, J. Li, L. Y. Beaulieu and J. R. Dahn, “A Study of the Transport Properties of Ethylene Carbonate-Free Li Electrolytes,” Journal of the Electrochemical Society, vol. 165, no. 3, 2018.
- O. Lavi, S. Luski, N. Shpigel, C. Menachem, Z. Pomerantz, Y. Elias and D. Aurbach, “Electrolyte Solutions for Rechargeable Li-Ion Batteries based on FLuorinated Solvents,” ACS Applied Energy Materials, vol. 3, pp. 7845-7499, 2020.
- L. C. Thomas, “TP006 Modulated DSC® Paper #1: Why Modulated DSC®? ; An Overview and Summary of Advantages and Disadvantages Relative to Traditional DSC,” TA Instruments, New Castle, DE.
- TA Instruments, “TN34 Thermal Applications Note: Modulated DSCTM: A Simple Technique With Significant Benefits,” TA Instruments, New Castle, DE.
- L. A. Robertson, Z. Li, Y. Cao, I. A. Shkrob, M. Tyagi, K. C. Smith, L. Zhang, J. S. Moore and Y. Z, “Observation of Microheterogeneity in Highly Concentrated Nonaqueous Electrolyte Solutions,” Journal of the American Chemical Society, vol. 141, no. 20, pp. 8041-8046, 2019.
- TA Instruments, “TN045: Choosing Conditions in Modulated DSC®,” TA Instruments, New Castle, DE.
Reconocimiento
Esta nota fue redactada por los doctores Jennifer Vail y Hang Lau de TA Instruments.
Haga clic aquí para descargar la versión imprimible de esta nota de aplicación.

