L’un des composants les plus critiques de la batterie est l’électrolyte, solution conductrice qui transporte les ions chargés positivement de la cathode à l’anode pendant le processus de décharge. Les électrolytes des batteries lithium-ion sont traditionnellement constitués d’un sel de lithium dissous dans un mélange de solvants organiques. Lors de la formation de la batterie, les composés solvantés et salins de l’électrolyte sont réduits sur l’anode pour produire l’interphase d’électrolyte solide (SEI), qui joue un rôle crucial dans le fonctionnement et la sécurité de la batterie.
Les chercheurs dans le domaine des batteries expérimentent actuellement différentes formulations d’électrolytes liquides, en gel, polymères et solides. Concevoir des électrolytes efficaces nécessite de trouver un équilibre entre la viscosité, la conductivité, la stabilité électrochimique et le coût. La plupart des électrolytes peuvent bien fonctionner à basse température, mais ont une stabilité thermique restrictive même à des températures modérées.
Les développeurs de batteries s’appuient sur l’analyse thermique pour mesurer la stabilité thermique des électrolytes et s’assurer que leur conception permet d’éviter la dégradation et les incendies potentiels. La calorimétrie différentielle à balayage (DSC) et l’analyse thermogravimétrique (TGA) permettent d’étudier la stabilité thermique de l’électrolyte, et ensemble ces deux méthodes offrent une analyse complète de ses propriétés thermiques. La rhéologie permet aux ingénieurs de mesurer la viscosité et de produire des solvants électrolytiques avec une pompabilité optimale pendant la fabrication.
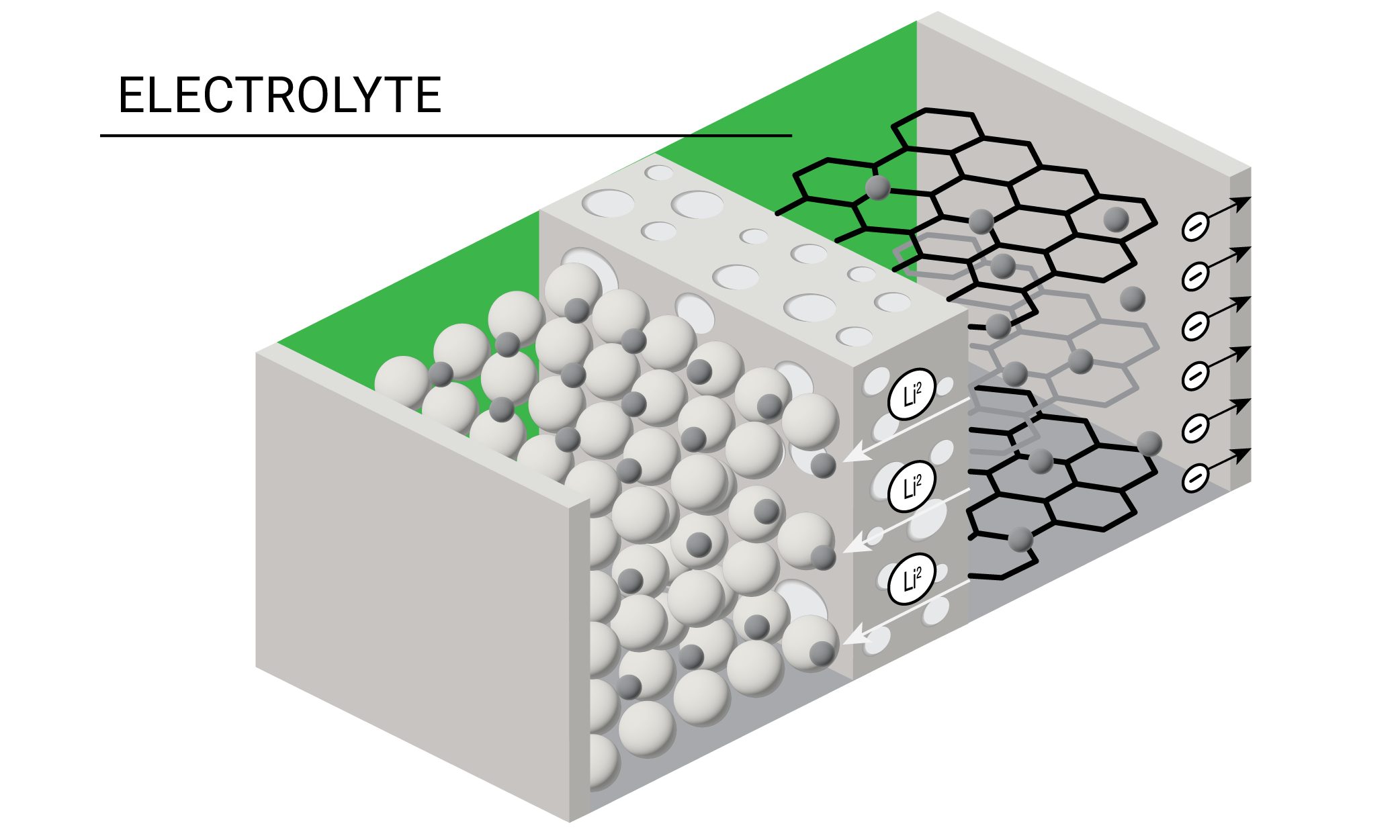
Instruments et paramètres de test
Matériau : solvants non aqueux
Exemples de matériaux : carbonates et solutions électrolytiques, hexafluorophosphate de lithium (LiPF6)
- Dégradation moléculaire des électrolytes et des additifs
Calorimétrie différentielle à balayage
- Formulation de l’électrolyte
- Fusion
- Cristallisation
- Stabilité thermique
- Température d’emballement thermique
- Chaleur de réaction
- Stabilité thermique
- Température de décomposition
- Détermination de la composition
- Taux de volatiles
- Détermination des impuretés
- Analyse des gaz émis, TGA-MS, TGA-FTIR, TGA-GCMS
- Analyse atmosphérique
- Fonctionnement compatible avec une boîte à gants
- Environnement purgé à l’argon et à l’azote
- Pompabilité, transport
- Contrainte seuil
- Viscosité (de Newton, rhéofluidification, rhéoépaississement)
- Viscoélasticité
- Effet des cycles de charge-décharge sur la conductivité
- Viscosité
- Électro-rhéologie
- Analyse atmosphérique
- Fonctionnement compatible avec une boîte à gants
- Environnement purgé à l’argon et à l’azote
Exemples d’application
Quels événements thermiques conduisent à l’emballement thermique ?
Bien que des questions restent en suspens sur le processus d’emballement thermique dans les batteries, les connaissances actuelles suggèrent qu’il est déclenché par la série d’événements suivants. Les réactions exothermiques qui conduisent à l’emballement thermique interagissent de manière destructive avec chaque composant interne d’une batterie lithium-ion (LIB) lorsque la température de la batterie continue d’augmenter ; certains éléments sont touchés de façon précoce tandis que la plupart accélèrent directement l’accumulation de chaleur lorsqu’ils se dégradent.
Le premier composant qui commence à se dégrader est l’interphase d’électrolyte solide (SEI). Ceci se produit généralement autour de 80-120 °C (176-248 °F). À ce stade, l’emballement thermique peut être ralenti, mais n’est plus réversible une fois que l’anode est exposée à l’électrolyte. Les réactions exothermiques qui se produisent à la surface de l’anode réactive augmentent davantage la chaleur dans le système jusqu’à ce qu’il atteigne les températures critiques suivantes.
Le séparateur est le deuxième composant affecté, et il cède en deux étapes. Vers 120-150 °C (248-302 °F), le séparateur commence à fondre et provoque un petit court-circuit, suivi d’un court-circuit interne plus grave lorsqu’il casse vers 220-250 °C (428-482 °F).
Les réactions suivantes se produisent rapidement et immédiatement après la plage de température précédente ; le matériau de la cathode, le liant et l’électrolyte commencent tous à se décomposer, ce qui élève considérablement la température de la cellule de la batterie qui atteint environ 800 °C (1 472 °F). Ces réactions libèrent des produits gazeux qui augmentent la pression à l’intérieur de la LIB.
Le premier composant qui commence à se dégrader est l’interphase d’électrolyte solide (SEI). Ceci se produit généralement autour de 80-120 °C (176-248 °F). À ce stade, l’emballement thermique peut être ralenti, mais n’est plus réversible une fois que l’anode est exposée à l’électrolyte. Les réactions exothermiques qui se produisent à la surface de l’anode réactive augmentent davantage la chaleur dans le système jusqu’à ce qu’il atteigne les températures critiques suivantes.
Le séparateur est le deuxième composant affecté, et il cède en deux étapes. Vers 120-150 °C (248-302 °F), le séparateur commence à fondre et provoque un petit court-circuit, suivi d’un court-circuit interne plus grave lorsqu’il casse vers 220-250 °C (428-482 °F).
Les réactions suivantes se produisent rapidement et immédiatement après la plage de température précédente ; le matériau de la cathode, le liant et l’électrolyte commencent tous à se décomposer, ce qui élève considérablement la température de la cellule de la batterie qui atteint environ 800 °C (1 472 °F). Ces réactions libèrent des produits gazeux qui augmentent la pression à l’intérieur de la LIB.
Thermogramme TGA qui met en évidence l’instabilité thermique du matériau de l’anode en graphite
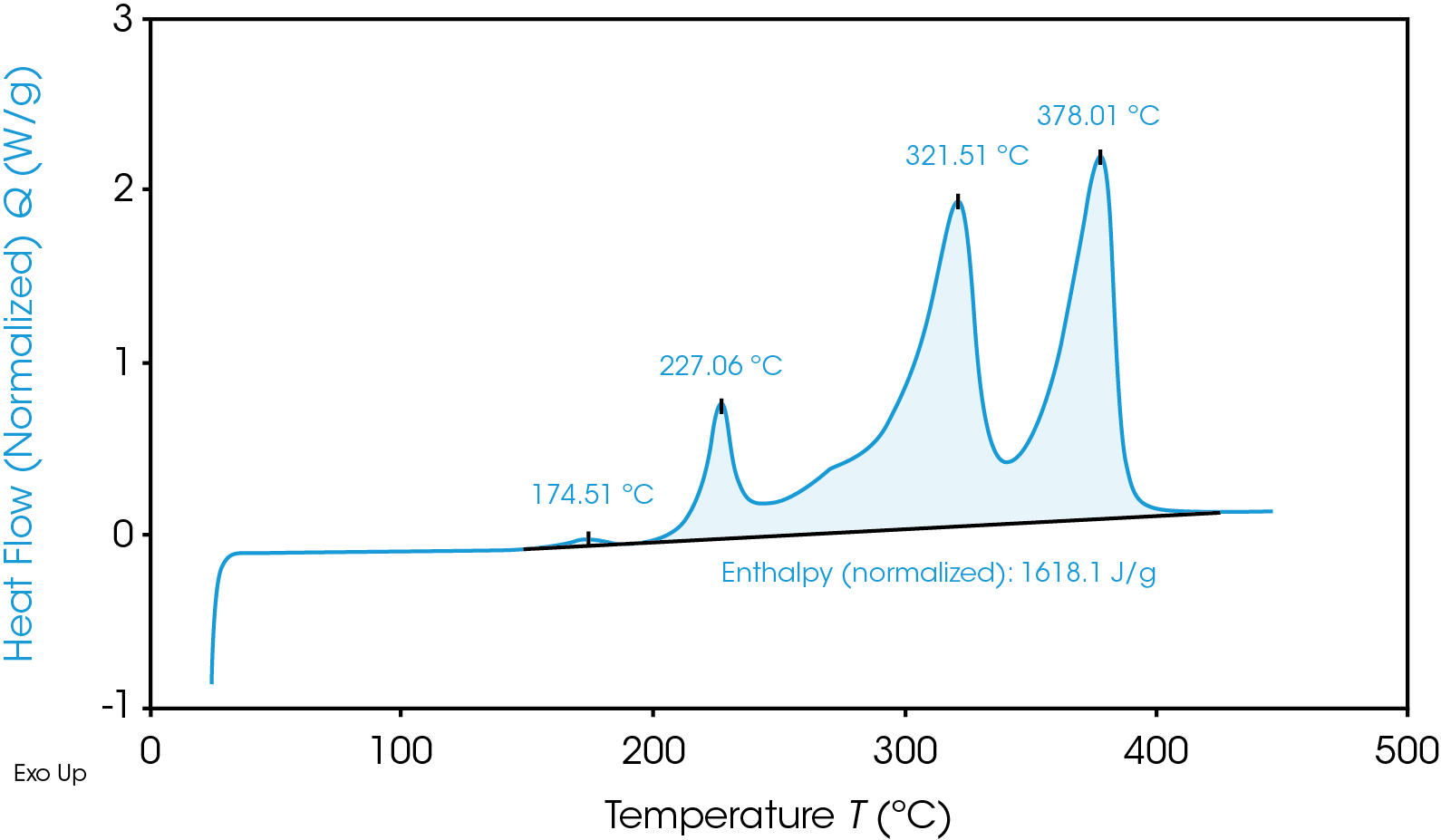
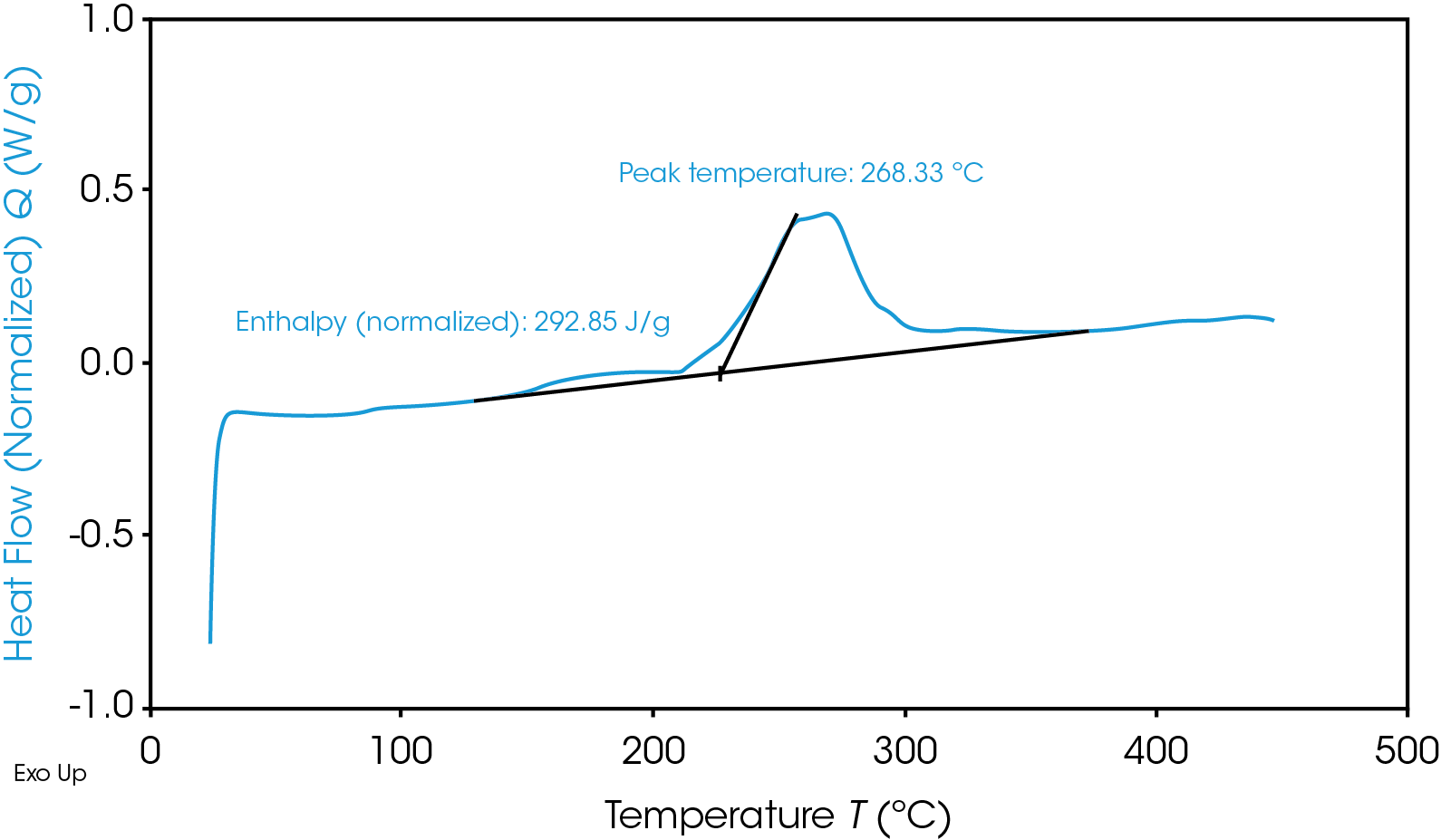
Outre la production rapide de chaleur, les réactions cathodiques dégagent un sous-produit nocif à base d’oxygène qui est inflammable. Selon les conditions exactes, le résultat immédiat est soit « Chaleur + Oxygène = Feu », soit « Chaleur + Gaz = Rupture/Explosion ». Bien sûr, tous les matériaux ne sont pas identiques et peuvent céder au bas ou au haut de ces plages, ou même en dehors de ces plages par la suite ; il est donc essentiel de choisir grâce à des tests appropriés les matériaux les plus sûrs possibles pour une batterie donnée.
Pour éviter l’emballement thermique et sélectionner des matériaux de batterie avec des tolérances thermiques optimales, les chercheurs dans le domaine des batteries se tournent vers la calorimétrie différentielle à balayage (DSC) et l’analyse thermogravimétrique (TGA) :
DSC : la DSC mesure le flux de chaleur qui entre ou sort d’un matériau en fonction de la température ou du temps. Les changements de phase interrompent la relation de capacité thermique entre le changement de température et la chaleur absorbée ou libérée et sont visibles sur le graphique de sortie. Ceci permet d’effectuer les tests dans différentes conditions qui vont de la température de fonctionnement sans risque à l’abus thermique.
TGA : la TGA mesure la masse d’un échantillon en fonction de la température ou du temps. De manière générale, un matériau plus stable thermiquement peut atteindre une température plus élevée avant qu’un changement de masse ne se produise.
La DSC permet d’obtenir les informations suivantes :
- La température de fusion du matériau, Tm.
- La température de transition vitreuse du matériau, Tg.
- La température de changement de phase la plus basse des différents matériaux qui composent la batterie.
La TGA permet d’obtenir les informations suivantes :
- La température à laquelle un matériau commence sa décomposition.
- La quantité de masse d’échantillon perdue par décomposition thermique ou oxydative à une température donnée.
- La vitesse des réactions de décomposition (à la fois oxydatives et thermiquement induites) à une température donnée.
- La température maximale thermiquement stable des différents matériaux qui composent la batterie.





