Palabras clave: microcalorimetría, electroquímica, baterías de iones de litio, reacciones parásitas, duración de la batería
MC169-ES
Resumen
Hacer pasar las baterías por ciclos hasta que fallan consume una cantidad de tiempo prohibitiva y retrasa el análisis de datos que es clave para el desarrollo de nuevas sustancias químicas de baterías. Un desafío continuo es determinar la actividad de las reacciones parásitas, que pueden tener repercusiones significativas en el rendimiento y la longevidad de las baterías de iones de litio. La calorimetría electroquímica in situ es la técnica líder para el estudio de estas reacciones parásitas. La solución de microcalorímetro ciclador de baterías combina microcalorimetría isotérmica sensible con análisis electroquímico. En este trabajo se utiliza para medir la energía parásita de una celda Panasonic NCR18650GA. Los resultados pueden utilizarse para predecir el ciclo y la vida útil, evaluar la calidad de la celda, ayudar en la formulación de materiales activos, investigar las repercusiones de los aditivos y estudiar la formación y el crecimiento de la interfase electrolítica sólida.
Introducción
El ciclo de vida, la eficiencia y la calidad general de una batería de iones de litio (BIL) están determinados en gran medida por la reversibilidad de las reacciones electroquímicas que ocurren durante la carga y la descarga [1]. Aun cuando la determinación del ciclo de vida es relativamente sencilla desde una perspectiva analítica, sigue siendo un cuello de botella importante en el flujo de trabajo de las pruebas [2]. Hacer pasar a una celda por ciclos hasta que falle es un proceso que puede llevar muchos meses, lo que lentifica significativamente el ritmo de la investigación y retrasa la información crucial para el control de calidad. Las nuevas tendencias de investigación se están enfocando en la identificación de atributos de diagnóstico que pueden usarse para predecir con precisión el comportamiento a largo plazo [2,3]. Un ejemplo representativo es el estudio de las reacciones parásitas, que se han asociado con desvanecimiento aumentado de la capacidad, eficiencia coulómbica disminuida y falla temprana de la celda [1,2,4,5]. Reacción parásita es un término general para cualesquier reacciones secundarias, químicas o electroquímicas que ocurren dentro de una batería. Estas pueden incluir la descomposición del solvente, el electrodepósito de litio, el crecimiento de la IES (interfase electrolítica sólida), descomposición de la IES y autodescarga [5].
La evaluación de la eficiencia coulómbica es la técnica clásica para medir cuánta energía se pierde en un ciclo de batería; se asume que las pérdidas dependen de reacciones parásitas (Ecuación 1).
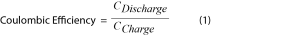
Si bien la determinación de la eficiencia coulómbica es útil, solo toma en cuenta la energía perdida por reacciones secundarias electroquímicas. Debido a la complejidad y la variedad de reacciones parásitas dentro de una batería de iones de litio, la totalidad del comportamiento de los procesos químicos y electroquímicos no se refleja en la eficiencia coulómbica [2,6]. Para capturar completamente la actividad de las reacciones parásitas en condiciones de paso por ciclos, se debe combinar una técnica analítica secundaria con estudio electroquímico in situ. La principal estrategia para que este esfuerzo tenga éxito es el acoplamiento de microcalorimetría isotérmica de alta resolución con técnicas electroquímicas establecidas [1,2,4,5,7].
La calorimetría electroquímica es una herramienta que examina la actividad de flujo de calor de una batería durante el paso por ciclos activo. Aun cuando se trata de una técnica poderosa, la complejidad y la laboriosidad del procesamiento de datos han inhibido su valor práctico. Este proceso generalmente implica adaptar el hardware para dar cabida a los experimentos, sincronizar los parámetros y los tiempos de inicio del experimento en dos instrumentos con distintas interfaces de software, fusionar los archivos de datos y realizar los cálculos necesarios antes de ver el primer gráfico. La solución de microcalorímetro ciclador de baterías de TA Instruments está diseñada para agilizar este proceso al integrar el calorímetro y el potenciostato en los ámbitos de hardware y software.
El microcalorímetro ciclador de baterías mide la actividad de flujo de calor en tiempo real de una batería al utilizar formatos de celda estándar como celdas de moneda, 18650 y de bolsa. Las mediciones se pueden realizar en un rango de temperaturas ambiente y condiciones variables de paso por ciclos. Los datos del calorímetro y del potenciostato se registran en el tiempo para correlacionar con precisión los eventos térmicos con los estímulos electroquímicos. La contribución térmica de las reacciones parásitas (energía parásita) se aísla de la señal de flujo de calor total al usar una serie de cálculos realizados automáticamente por TAM Assistant, el software de análisis y adquisición de datos de TA Instruments. En esta nota, la solución de microcalorímetro ciclador de baterías de TA Instruments se utiliza para investigar la eficiencia de la batería y las reacciones parásitas de una celda Panasonic NCR18650GA.
Experimental
La solución de microcalorímetro ciclador de baterías integra un potenciostato de alta precisión, el potenciostato BioLogic VSP-300, con el microcalorímetro isotérmico TAM IV de TA Instruments. TAM Assistant controla tanto el calorímetro como el potenciostato para correlacionar automáticamente los eventos de flujo de calor con la electroquímica en los archivos de resultados, como se muestra en la Figura 1.
Los elevadores precableados para el TAM IV hacen contacto eléctrico entre el potenciostato y la batería mientras que también minimizan el ruido proveniente de fluctuaciones térmicas ambientales en la habitación. Hay clips de resorte en las terminales superior (+) e inferior (-) que hacen un contacto firme entre la batería y el elevador, sin que se necesite soldadura ni aislamiento eléctrico adicional. La conexión de cuatro cables se realiza a la batería en una configuración de dos electrodos, con dos cables para la corriente y dos cables para el sentido de voltaje (+/-). Los cuatro cables conducen a un conector codificado, donde un cable (recortado a la medida) hará interfaz con las derivaciones del potenciostato. En la Figura 2 se detallan los distintos componentes de diseño en el elevador de macrocalorímetro para celdas de batería 18650.


Calibración
El sistema se calibra al usar el calentador de calibración en forma de batería externo (cuadro de la Figura 3) que se encuentra disponible para cada tipo de elevador. Estos calentadores de calibración imitan las dimensiones físicas de una celda real y contienen un reóstato de alta precisión de 1000 Ω para emitir una cantidad conocida de calor. El TAM Assistant contiene una amplia variedad de asistentes de experimentos, incluyendo un asistente de calibración para guiar al usuario por el método.
Para comenzar la calibración, se instala el calentador de calibración en el elevador y se carga en el calorímetro al utilizar el procedimiento operativo estándar que se encuentra en la Guía de inicio del microcalorímetro ciclador de batería. Se permite que el calentador de calibración alcance el equilibrio térmico con la temperatura del baño, y que la basal se estabilice. Cuando se indique, el potenciostato aplicará un pulso de corriente, lo que hará que la batería de calibración emita una cantidad conocida de calor. En la Figura 3 se muestra el archivo de resultados para una calibración de ganancia, con las señales de voltaje y flujo de calor graficadas en comparación con el tiempo.
Este método de calibración produce valores tanto para la ganancia como para la compensación. Antes del envío, en una instalación de TA Instruments se realizan calibraciones dependientes de la temperatura en cada calorímetro vacío. Cualquier cambio de la configuración del calorímetro, incluyendo la inserción del elevador, da lugar a una desviación desde el valor calibrado. El factor de ganancia corrige estas diferencias y produce una constante de ganancia única para la configuración del usuario. La compensación es la desviación de la señal basal desde cero, la cual se ajusta automáticamente después de la calibración.
Determinación del calor parásito en una BIL 18650
El baño del TAM IV se configuró a 40 °C y se permitió que se estabilizara durante 24 horas. Una celda BIL Panasonic NCR18650GA de 3400 mAh se cargó en el elevador de batería y se insertó en el calorímetro con el método estándar. La batería se hizo pasar por ciclos previos entre 3.0 y 4.2 V a 250 mA, durante un total de 10 ciclos para acondicionar la batería a la temperatura de prueba (se recomiendan de 10 a 20 ciclos). Después de esto, hubo un período de reposo de 24 horas para alcanzar el equilibrio térmico y estabilizar las sustancias químicas de la batería. El calor parásito se debe medir a tasas de paso por ciclo de carga lentas (tasas C) para obtener los mejores resultados. Esta celda se hizo pasar por ciclos a 172 mA (C/20), durante 5 ciclos entre 3.0 y 4.2 V, con un período de reposo de 1 hora entre cada paso de carga y de descarga. El asistente de ciclador de batería en TAM Assistant se utilizó para programar el experimento y ejecutarlo.
Antecedentes teóricos
La señal de flujo de calor durante el paso de la batería por ciclos se describe en la Ecuación 2 [1,5,7]
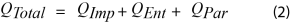
Donde:
- QTotales el flujo de calor total
- QPares la energía parásita
- QImpes la potencia de impedancia
- QEnt es la energía entrópica
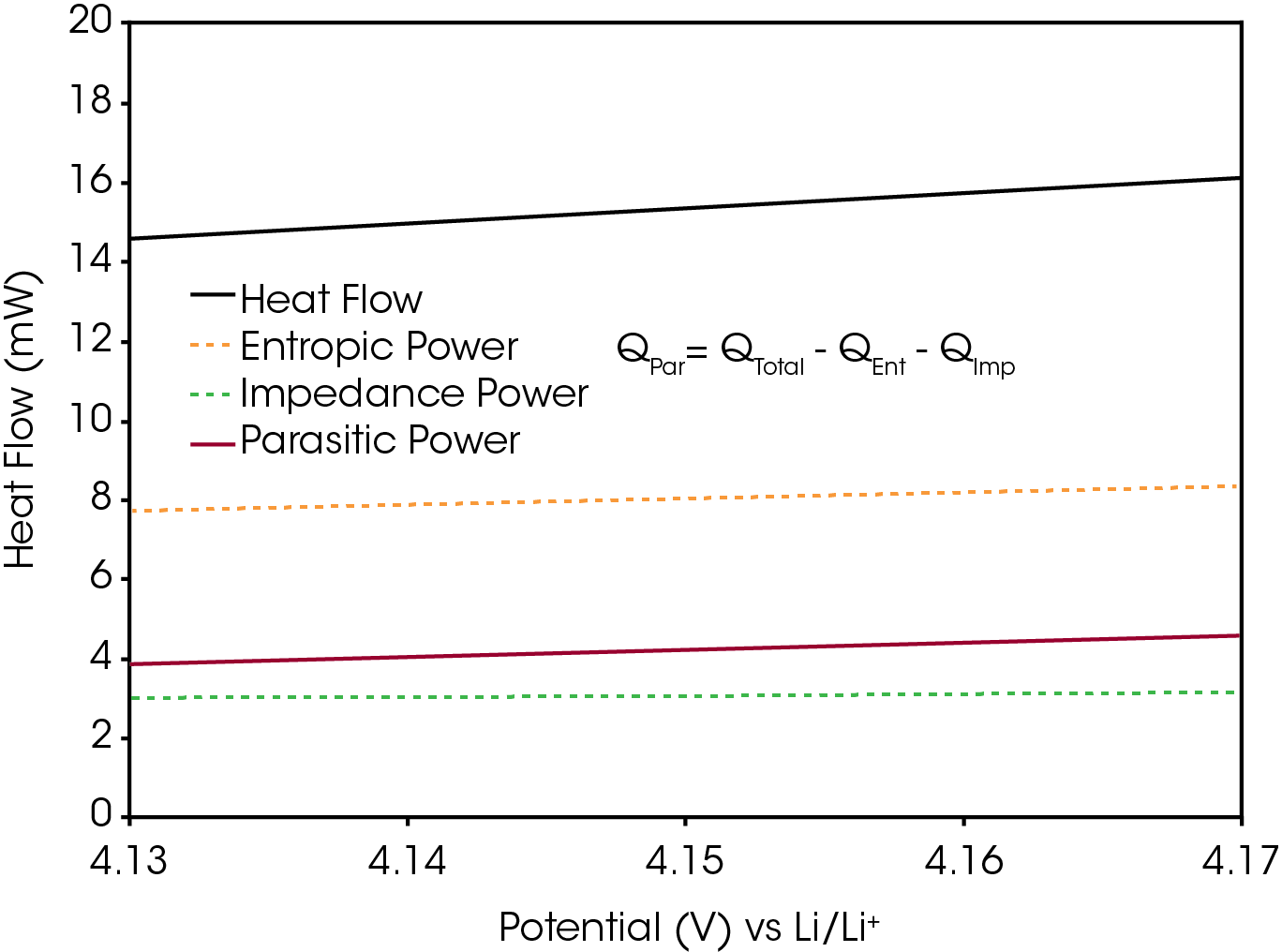
La principal señal de interés es QPar, la energía parásita. Esta es la suma de la energía térmica que se produce por las reacciones secundarias irreversibles en una batería. Para aislar esta señal del flujo de calor total, se deben restar la potencia de impedancia (QImp) y la energía entrópica (QEnt). La energía entrópica describe el flujo de calor asociado con cambios reversibles de la entropía. Generalmente es la contribución más grande al flujo de calor total durante una operación de carga o de descarga, como se observa en la Figura 4. La energía entrópica se produce principalmente por la intercalación/desintercalación de litio y los cambios estructurales correspondientes de los materiales activos, como la expansión de la capa de grafito. Estos procesos son reversibles, de modo que sus flujos de calor asociados también lo son. Por lo tanto, la energía entrópica durante la carga debe ser de igual magnitud, pero de signo opuesto, a la energía entrópica durante la descarga [5]. En la Ecuación 3 se describe la suma de los flujos de calor totales integrados durante un ciclo completo para eliminar la contribución de QEnt de QTotal, dejando solo QPar y QImp.
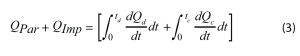
Donde Q es la señal de flujo de calor, t es el tiempo y los subíndices d o c denotan una operación de descarga y de carga, respectivamente.
La potencia de impedancia es el calor residual que se genera al pasar corriente a través de un material resistivo, también conocido como calentamiento de Joule. Puede calcularse a partir de los datos electroquímicos y la Ecuación 4.
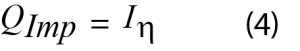
Donde I es la corriente aplicada y η es la sobretensión.
La sobretensión en esta ecuación representa la diferencia entre el voltaje de circuito abierto y el voltaje cuando está bajo carga. La corriente aplicada será constante, pero la sobretensión variará dependiendo del estado de carga. Se puede medir directamente al aplicar un pulso de circuito abierto a intervalos periódicos, o al graficar el voltaje contra la capacidad y medir la histéresis de las curvas de carga y de descarga. Durante un ciclo completo, la potencia de impedancia promedio se puede calcular con la Ecuación 5.
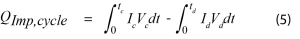
Donde I es la corriente aplicada y V es el voltaje durante una operación de carga o de descarga.
Esta señal siempre es exotérmica, pero su contribución se puede minimizar al usar tasas C lentas. Una vez que se determinan los valores promedio para la impedancia y la energía entrópica, la Ecuación 6 se puede usar para determinar la energía parásita promedio por cada ciclo.
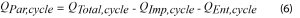
Donde, por definición, QEnt,ciclo será igual a cero.
Resultados y discusiones
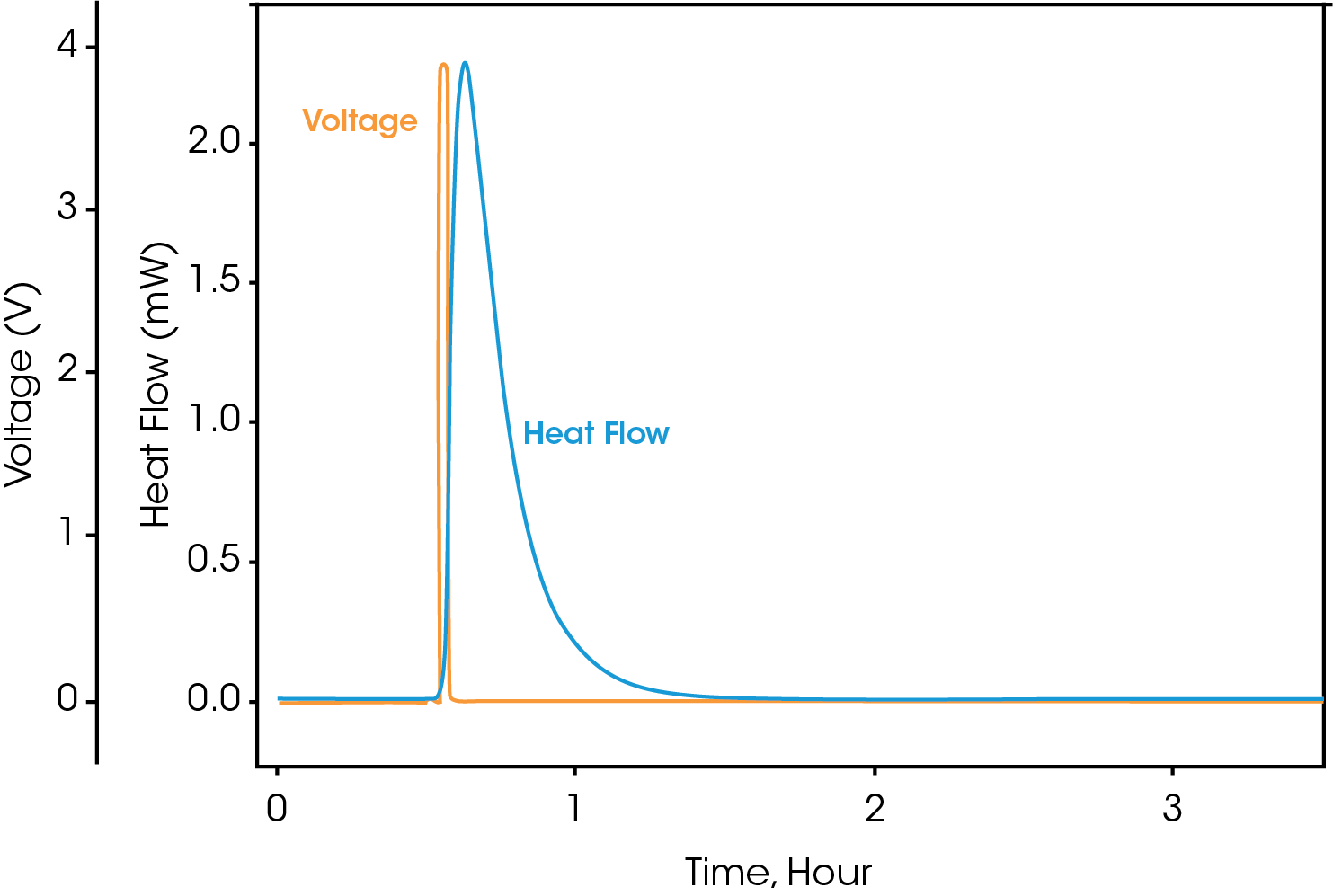
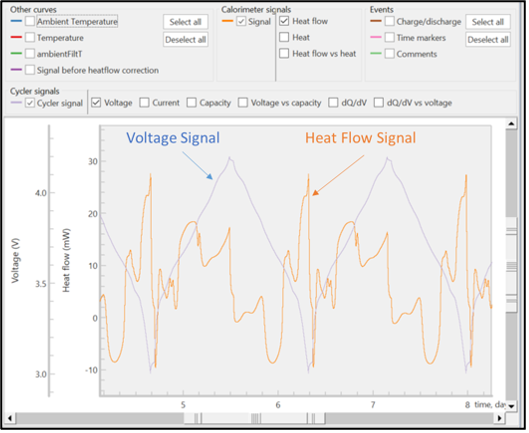
En la Figura 5 se muestran las señales no procesadas de flujo de calor y voltaje. Todas las señales sin procesar tienen un registro de tiempo, de modo que los datos electroquímicos y del calorímetro puedan correlacionarse con exactitud. Las señales sin procesar de voltaje, corriente y flujo de calor se pueden observar durante un experimento activo, pero los valores calculados solo se pueden obtener después de que el experimento ha finalizado.
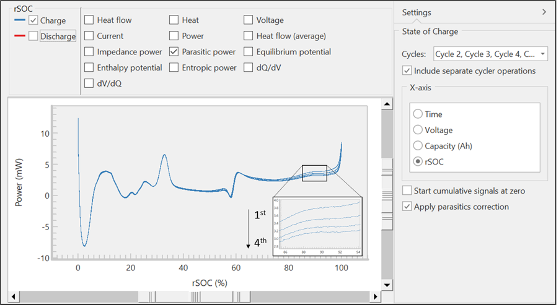
A partir de estas señales sin procesar, el TAM Assistant calculará automáticamente los valores clave y los presentará en una tabla o como un gráfico. En la Figura 6 se muestra una vista de la ventana de graficado, con varias opciones para el eje x a la derecha y muchas opciones para el eje y cerca de la parte superior de la ventana. El software incluye la capacidad de superponer diferentes señales calculadas y sin procesar, superponer diferentes ciclos y separar la carga y la descarga. Estas herramientas se diseñaron para maximizar la flexibilidad, la velocidad y la facilidad de uso, de modo que los operadores pudieran encontrar con mayor eficiencia tendencias o características clave dentro de los datos.
Los datos de la Figura 6 muestran la energía parásita de la rama de carga durante cuatro ciclos contra el estado de carga relativo (relative state of charge, rSOC). Los picos en los límites superior e inferior del rSOC son artefactos que se producen por la asimetría inherente cerca de los bordes de las curvas de voltaje y flujo de calor. Estos se denominan efectos de borde [5]. Una inspección más detallada de las curvas superpuestas mostrará la disminución de la energía parásita con cada ciclo, lo cual coincide con el comportamiento clásico para la formación de una capa de pasivación, como la IES [8].
A lo largo de múltiples ciclos, también pueden observarse tendencias en los datos. En la figura 7 se muestran la energía parásita y la eficiencia coulómbica promedio entre cuatro ciclos. A medida que la energía parásita disminuye, la eficiencia coulómbica aumenta, lo cual concuerda con estudios previos [5]. Esto coincide con las expectativas teóricas puesto que están midiendo el mismo evento desde lados opuestos. La eficiencia coulómbica es una medida de la eficiencia electroquímica; por el contrario, la energía parásita es una medida de la ineficiencia, incluyendo las reacciones secundarias tanto químicas como electroquímicas. Es una buena práctica hacer un seguimiento de la eficiencia coulómbica, porque puede utilizarse para validar los datos térmicos, como se hace en la Figura 7.

Conclusiones
La cuantificación de la actividad parásita es crucial para juzgar la eficiencia y la calidad, y para comprender la química subyacente de las baterías de iones de litio. Se utilizó una solución de microcalorímetro ciclador de baterías de TA Instruments para investigar la energía parásita en una celda Panasonic NCR18650GA. El TAM Assistant facilita la integración y el control del termostato, los calorímetros y el potenciostato, lo que mejora la utilidad práctica y la facilidad de uso de la calorimetría de baterías. Durante múltiples ciclos, se miden tendencias como la eficiencia coulómbica creciente con la energía parásita en disminución. Estos datos pueden ayudar a los investigadores con nuevas formulaciones de materiales activos, al mostrar las repercusiones de los aditivos en la reducción de la actividad parásita, estudiar la IES y descartar celdas que tienen una actividad parásita más alta que la normal en el control de calidad.
Referencias
-
- L.J. Krouse, L.D. Jensen, J.R. Dahn. Measurement of Parasitic Reactions in Li Ion Cells by Electrochemical Calorimetry. J. Electrochem. Soc. 2012, 159 (7), A937-A943.
pdf (iop.org) - J.C. Burns, Adil Kassam, N.N. Sinha, L.E. Downie, Lucie Solnickova, B.M. Way, J.R. Dahn. Predicting and Extending the Lifetime of Li-Ion Batteries. J. Electrochem. Soc. 2013, 160, A1451.
Predicting and Extending the Lifetime of Li-Ion Batteries – IOPscience - Wei Xiong, Gang Xu, Yumei Li, Feng Zhang, Pang Ye, Ben Li. Early prediction of lithium-ion battery cycle life based on voltage-capacity discharge curves. Journal of Energy Storage, 2023, 62, 106790. Early prediction of lithium-ion battery cycle life based on voltage-capacity discharge curves – ScienceDirect
- L.E. Downie, S.R. Hyatt, J.R. Dahn. The Impact of Electrolyte Composition on Parasitic Reactions in Lithium Ion Cells Charged to 4.7 V Determined Using Isothermal Microcalorimetry. J. Electrochem. Soc. 2016, 163 (2), A35-A42.pdf (iop.org)
- L.J. Krouse, L.D. Jensen, V.L. Chevrier. Measurement of Li-Ion Battery Electrolyte Stability by Electrochemical Calorimetry. J. Electrochem. Soc. 2017, 164 (4), A889-A896.Measurement of Li-Ion Battery Electrolyte Stability by Electrochemical Calorimetry – IOPscience
- Seong Jin An, Jianlin Li, Claus Daniel, Debasish Mohanty, Shrikant Nagpure, David L. Wood. The state of understanding of the lithium-ion-battery graphite solid electrolyte interphase (SEI) and its relationship to formation cycling. Carbon, 2016, 105, 52-76.
- Alexander Kunz, Clara Berg, Franzika Friedrich, Hubert A. Gasteiger, Andreas Jossen. Time-Resolved Electrochemical Heat Flow Calorimetry for the Analysis of Highly Dynamic Processes in Lithium-Ion Batteries. J. Electrochem. Soc. 2022, 169, 080513.Time-Resolved Electrochemical Heat Flow Calorimetry for the Analysis of Highly Dynamic Processes in Lithium-Ion Batteries – IOPscience
- Luchkin, S.Y., Lipovskikh, S.A., Katorova, N.S., Savina, A.A., Abakumov, A.M, Stevenson, K.J. Solid-electrolyte interphase nucleation and growth on carbonaceous negative electrodes for Li-ion batteries visualized with in situatomic force microscopy. Sci Rep,2020, 10, 8550. https://doi.org/10.1038/s41598-020-65552-6
- L.J. Krouse, L.D. Jensen, J.R. Dahn. Measurement of Parasitic Reactions in Li Ion Cells by Electrochemical Calorimetry. J. Electrochem. Soc. 2012, 159 (7), A937-A943.
Reconocimiento
Jeremy May, PhD, en TA Instruments, escribió este documento
Haga clic aquí para descargar la versión imprimible de esta nota de aplicación.

